Una cantidad cada vez mayor de microorganismos está adquiriendo resistencia antimicrobiana (AMR, por sus siglas en inglés) a agentes que se utilizan para combatirlos (por ejemplo, antibióticos).1 Esto supone un desafío para los recursos clínicos y de presupuesto a nivel mundial.2 El problema es exacerbado por el hecho de que el desarrollo de nuevos antibióticos es lento y cada vez menor, y se ha rezagado por el incremento en la resistencia de estos microorganismos; por lo tanto, se requieren nuevas estrategias para atacar este problema.3,4,5
Se han hecho grandes avances utilizando un estricto control de las infecciones y enfocándose en el uso de antibióticos, lo que provoca una reducción de las infecciones por microorganismos resistentes a antibióticos.6
Los Programas de Protección Antimicrobiana (AMS, por sus siglas en inglés) son un esfuerzo sistemático por informar, educar y persuadir a los profesionales de la salud que prescriben antimicrobianos a utilizar la prescripción basada en evidencia para detener el sobreuso de antibióticos y ayudar a reducir la AMR.2 Sin embargo, además de los programas AMS, se requieren urgentemente nuevos métodos para tratar bacterias resistentes, especialmente para el cuidado de la herida. Esto ha sido resaltado por la European Wound Management Association (EWMA) como el desafío clave para los profesionales de la salud en el campo del cuidado de heridas.7,8 Se ha enfatizado, también, por iniciativas con las que actualmente está involucrada la EWMA, tales como podcasts sobre AMS,9 y estableciendo colaboraciones con organizaciones y grupos que tengan objetivos mutuos y similares con respecto a la AMR (como la British Society for Antimicrobial Chemotherapy).7
A partir de evidencia de laboratorio y clínica, este artículo presenta el caso para utilizar apósitos para heridas que brinden un mecanismo físico de acción antimicrobiana para prevenir y/o tratar infecciones de forma efectiva, en línea con la premisa de AMS, para reducir el uso de antibióticos.
Métodos
Se realizó una búsqueda de artículos relevantes relacionados con el uso de apósitos para heridas y de AMS en el cuidado de la herida, publicados entre enero de 1970 y noviembre de 2020, en las bases de datos de revisiones sistemáticas Medline, Cochrane y Google Scholar. Se utilizó la siguiente estrategia de búsqueda de palabras claves: ‘antimicrobial stewardship’, ‘wound AND dressing’, ‘ulcer’ y ‘antibiotic resistance’. Además, los autores realizaron una búsqueda manual de revistas sobre el cuidado de heridas no citadas en Medline/PubMed (por ejemplo, Wounds UK y Wounds International).
Se incluyeron los datos de ambos tipos de ensayos clínicos, aleatorizados y no aleatorizados, de estudios de cohorte clínica y de reportes de series de casos escritos en inglés. Se excluyeron los estudios in vitro, los reportes de caso, las series de casos y los artículos que no estaban escritos en inglés. Este artículo no tuvo como propósito ser una revisión sistemática, sino presentar las generalidades narrativas.10
Tratamientos para infección de heridas
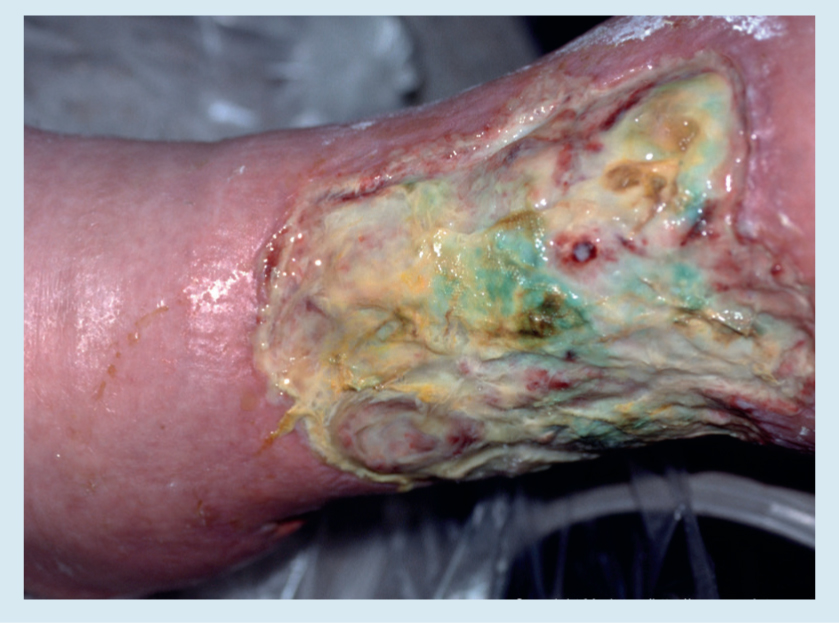
Un aspecto importante del manejo de la herida es el uso de agentes antimicrobianos para tratar la infección, que es una de las complicaciones más frecuentes de las heridas, especialmente en las de difícil cicatrización.11 En los peores casos, la infección de herida puede causar condiciones fatales.12 La Figura 1 ilustra una herida difícil de cicatrizar infectada con Pseudomonas aeruginosa.
En el campo del cuidado de heridas hay innumerables estrategias para el tratamiento de infecciones. Los antimicrobianos tradicionales (antibióticos y antisépticos) reducen directamente la biocarga e inhiben el crecimiento/división de células bacterianas de los microorganismos de la herida,13 o bien los matan para controlar la biocarga. Los abordajes novedosos ayudan a la eliminación de los microorganismos intactos de las heridas (por ejemplo, la fijación y eliminación de microorganismos por apósitos para herida recubiertos con cloruro de dialquilcarbamilo (DACC)) en lugar de matar activamente las bacterias, y crean un mecanismo físico para el control de la biocarga.14,15
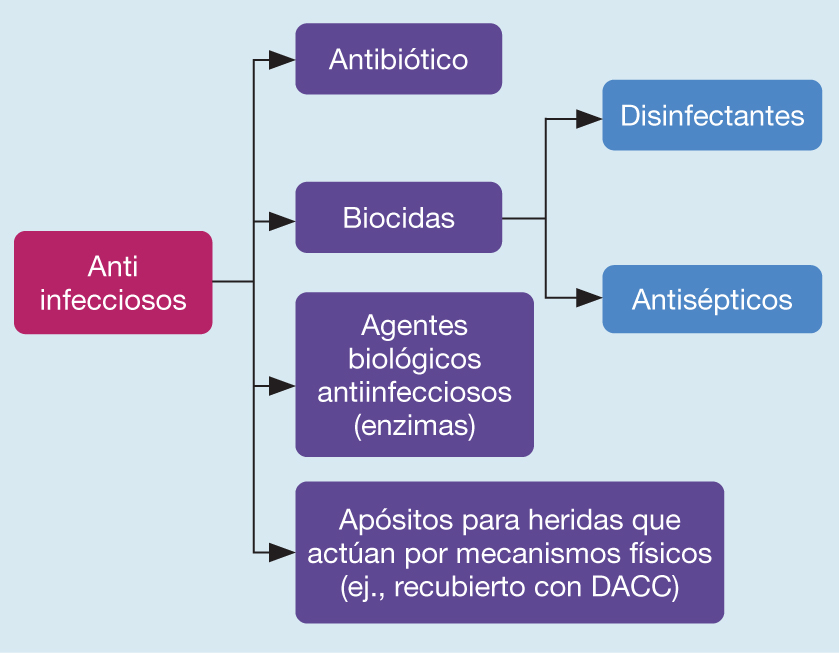
Los antimicrobianos utilizados en el cuidado de la herida pueden dividirse en varias categorías, que incluyen antibióticos, biocidas y agentes biológicos antiinfecciosos (Figura 2). El riesgo de desarrollar AMR ha provocado la recomendación de no utilizar antibióticos tópicos para el tratamiento de heridas difíciles de sanar.11 Los antimicrobianos no antibióticos ampliamente utilizados en el cuidado de la herida incluyen antisépticos, tales como clorhexidina,16 povidona o cadexómero yodado,17,18 polihexametileno biguanida (PHMB),19 metales (por ejemplo, plata)20 y productos naturales (tales como la miel).21,22 Como sucede con el uso de antibióticos, el uso generalizado de antisépticos de concentración baja ha generado dudas acerca de la posibilidad de que se produzca resistencia a antisépticos,23 aunque se ha discutido muy poco sobre la resistencia de los asépticos en los lineamientos del tratamiento.24
En forma tópica, los antimicrobianos pueden ser útiles en infecciones localizadas (superficiales) de heridas de difícil cicatrizaación,11 aunque algunos antimicrobianos tópicos (por ejemplo, antisépticos) podrían retrasar la cicatrización de la herida,11,25,26 causar irritación en la piel alrededor de la herida,11 y generar efectos citotóxicos potenciales en la base de la herida, especialmente con el tratamiento a largo plazo.27 Este aspecto negativo del tratamiento antimicrobiano ha generado debate acerca del uso de antimicrobianos tópicos para el tratamiento de heridas; se presentaron reportes de citotoxicidad in vitro con clorhexidina28 y povidona yodada,29,30 y reacciones clínicas adversas.31
Apósitos antimicrobianos
El desarrollo de nuevos fármacos y oportunidades clave (fijación y eliminación bacteriana, en lugar de muerte activa) es un requisito fundamental en la batalla contra la AMR. Los apósitos antimicrobianos son un ejemplo de la limitada exposición de los antimicrobianos a los sitios de infección locales, y una herramienta importante en la terapia antimicrobiana actual; se ha demostrado que el uso de combinaciones de antibiofilms/agentes antimicrobianos logra un manejo efectivo de la infección y el biofilm, además de facilitar la progresión de la cicatrización.32
En términos de focalización selectiva de bacterias, se han incorporado varios agentes antimicrobianos en diferentes tipos de apósitos.33 Los antisépticos comunes, como la plata, yodo y PHMB pueden lograr una acción antimicrobiana afectiva en un amplio rango de patógenos de la herida, y cada vez más publicaciones de evidencia in vitro respaldan su uso.2,8,34
En contraste, existen apósitos para herida que no contienen agente activo, pero que actúan fijándose a las bacterias para prevenir/reducir la infección. Lo logran reduciendo la biocarga local de una herida a través de la absorción física, el aislamiento y la eliminación de microorganismos de la base de la herida. Existe una gran cantidad de evidencia clínica que respalda el uso de apósitos para heridas a base de DACC para prevenir y reducir la infección por medio de la fijación bacteriana.35 Dicha evidencia ilustra la forma en que estos apósitos, que actúan por medios físicos, pueden ser utilizados exitosamente para prevenir/tratar infecciones de herida y estar alineados con los requisitos de la estrategia AMS.
El DACC es un derivado de los ácidos grasos. Es altamente hidrofóbico, y la hidrofobicidad tiene un papel crucial en la adherencia de los microorganismos a las superficies.36 Los microorganismos comúnmente responsables de provocar infecciones del sitio quirúrgico (SSI, por sus siglas en inglés) o para la colonización de heridas de difícil cicatrización generalmente tienen superficies extracelulares hidrofóbicas, y se adherirán de forma irreversible al recubrimiento DACC de los apósitos.37
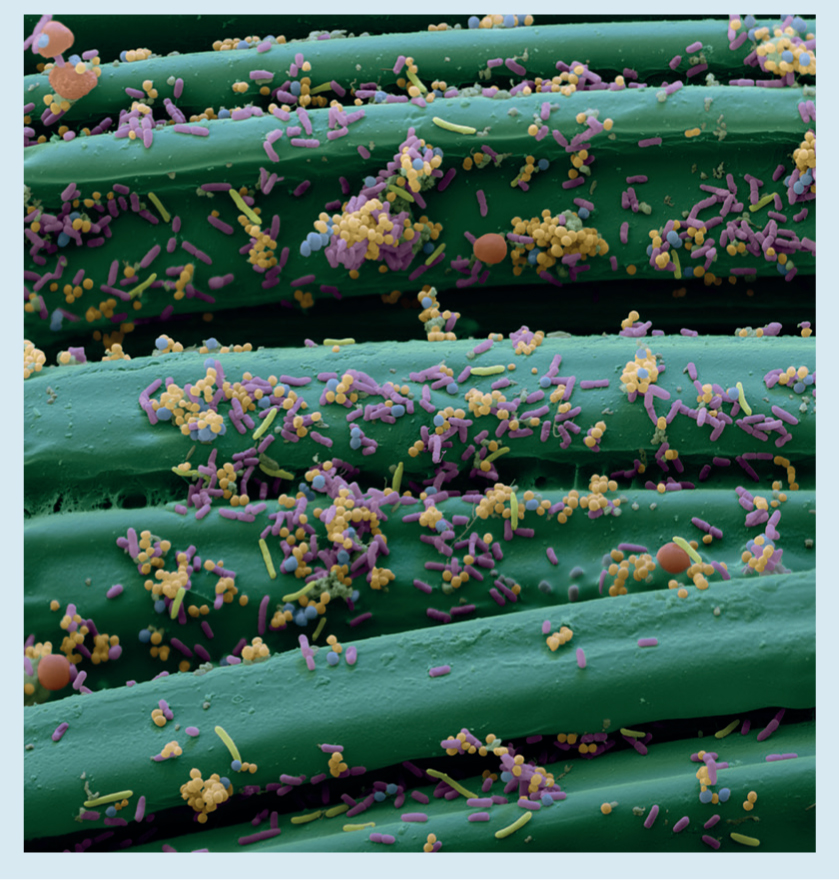
Se ha demostrado que varios microorganismos importantes en la infección de herida se fijan al material recubierto con DACC (Figura 3), incluyendo los microorganismos resistentes a múltiples fármacos, como Staphylococcus aureus, resistentes a meticilina, y microorganismos presentes como parte del biofilm.38 Un amplio rango de estudios que exploran numerosos tipos de heridas (SSI, heridas de difícil cicatrización, quemaduras) han demostrado el uso efectivo de apósitos recubiertos con DACC en la prevención y manejo de infección de heridas y reducción de biocarga (Cuadro 1 y Cuadro 2).
| Estudio | Microorganismos | Resultados principales |
|---|---|---|
| Wadström et al., 1985148 | Staphylococcus aureus | En un modelo porcino de herida infectada, el apósito hidrofóbico eliminó la infección y permitió la cicatrización de la herida. La infección no desapareció con los apósitos no hidrofóbicos |
| Bowler et al., 1999149 | Staphylococcus aureus Pseudomonas aeruginosa | En un sistema de pruebas de laboratorio, los apósitos recubiertos con DACC absorbieron y retuvieron los microorganismos a prueba, y tuvieron un mejor desempeño que el apósito de alginato de calcio |
| Ljungh et al., 200639 | Staphylococcus aureus Pseudomonas aeruginosa Enterococcus faecalis Bacteroides fragilis Fusobacterium nucleatum Candida albicans | Hubo niveles significativos de fijación al apósito recubierto con DACC para todos los microorganismos analizados. Se observó fijación después de 10 minutos y el pico máximo se detectó tras dos horas. La reducción de la hidrofobicidad de los microorganismos provocó que los apósitos hidrofóbicos fueran menos efectivos |
| Brackman et al., 2013150 | Staphylococcus aureus Staphylococcus epidermidis | El apósito recubierto con DACC fijó a un cultivo de suspensión de Staphylococcus aureus antes de la formación de biofilm en una prueba de laboratorio, y pudo prevenir significativamente la formación de biofilm en los biofilms desarrollados in vitro en un modelo de heridas de difícil cicatrización |
| Geroult et al., 2014151 | Mycobacterium ulcerans | Los microorganismos mostraron una fijación significativamente mayor que los apósitos recubiertos con DAAC en comparación con el apósito de control |
| Ronner et al., 201442 | Staphylococcus aureus (incluyendo MRSA) | Todas las cepas de Staphylococcus aureus se fijaron bien a los apósitos recubiertos con DACC en estudios de laboratorio, independientemente de la sensibilidad a antibióticos del microorganismo |
| Cooper y Jenkins, 201638 | MRSA Pseudomonas aeruginosa | En una prueba de laboratorio, el apósito recubierto con DACC se fijó de forma efectiva a biofilms, tanto de MRSA como de Pseudomonas aeruginosa. Pseudomonas aeruginosa tuvo una mayor afinidad a los apósitos que a MRSA |
DACC: cloruro de dialquilcarbamilo; MRSA: Staphylococcus aureus resistente a meticilina
| Tipo | Resultados principales |
|---|---|
| Heridas agudas |
|
| Heridas de difícil cicatrización |
|
| Infecciones |
|
DACC: cloruro de dialquilcarbamilo; UPD: úlcera de pie diabético; NPWT: terapia con presión negativa; NSD: apósito de solución salina normal; UPP: úlcera por presión; SSD: sulfadiazina de plata; UVP: úlcera venosa en pierna
Una vez que los microorganismos se fijan al apósito recubierto con DACC (Figura 3) pueden ser eliminados de la herida.39 Esto reduce la biocarga de la herida y mejora la cicatrización; estudios clínicos han demostrado la eliminación de los signos de infección en pacientes con heridas colonizadas o infectadas cuando se tratan con apósitos DACC (Cuadro 2). Además, Stanirowski et al.40 demostraron que el uso de apósitos con fijación bacteriana después de una cesárea tiene el potencial de reducir la incidencia de SSI y los costos del tratamiento. Por lo tanto, la reducción de la carga de microorganismos ayuda a crear las condiciones óptimas para la cicatrización de la herida.39 Debido a que el mecanismo de la acción antimicrobiana con DACC es la fijación física y la eliminación, la ausencia de muerte de células de microorganismos y su alteración—tal como sucedería con la acción de los antibióticos, otros agentes antimicrobianos o antisépticos—evita la liberación de endotoxinas en la base de la herida, y minimiza el estímulo inflamatorio adicional.41
En una revisión sistemática reciente, Totty et al.35 comentaron que, debido a la naturaleza física del mecanismo de acción de DACC propuesto, no hay riesgo de que las bacterias desarrollen resistencia. Además, estos apósitos se fijan a los microorganismos resistentes a antibióticos como MRSA.38,42 El modo de acción antimicrobiano basado en la fijación bacteriana física significa que estos apósitos no liberan ningún agente antimicrobiano químico o farmacológico, lo cual podría explicarse por la ausencia de eventos adversos hasta la fecha por el uso de apósitos recubiertos con DACC, y sugiere que estos apósitos pueden ser utilizados en todos los grupos de pacientes y heridas.43
Resistencia antimicrobiana
La discusión sobre la resistencia antimicrobiana tiende a enfocarse en la resistencia a antibióticos. Pero, al igual que con el uso de antibióticos, el uso extendido de biocidas, tales como antisépticos, especialmente en niveles bajos, ha provocado el surgimiento de dudas relacionadas con la posible aparición de resistencia antiséptica en microbios,23 un problema que debe ser reconocido. Sin embargo, los datos relacionados con el mecanismo de resistencia y la implicación de la resistencia antiséptica en heridas son limitados en comparación con los datos relacionados con resistencia antibiótica.24
Las bacterias expuestas a dosis subletales de antibióticos pueden mutar y resistir los tratamientos antibióticos por medio de la selección natural de los cambios genéticos que confieren resistencia.44 El uso generalizado de antibióticos en hospitales y en el ámbito clínico, junto con que son seguros y efectivos, además de económicos, ha provocado su uso incorrecto, sin prescripción médica y excesivo en infecciones autolimitantes.45,46,47 Pocos estudios han intentado cuantificar el nivel de prescripción inadecuada de antibióticos.48 Los datos sobre la prevalencia del uso inapropiado de antimicrobianos varían. Un estudio realizado en EEUU en 2007 indicó que, en hospitales, hasta el 50% del uso de antimicrobianos era inapropiado.49 Una encuesta más reciente, realizada en 2016, sugirió que en un estimado de 30% de pacientes ambulatorios, las prescripciones de antibióticos pudieron haber sido inapropiadas.50 Otro estudio sugiere que aproximadamente el 20% de los antibióticos es inapropiadamente prescrito en centros de atención primaria del Reino Unido.48
El mundo está enfrentando una crisis que empeora rápidamente, relacionada con el aumento en las tasas de resistencia de los patógenos bacterianos a los agentes antimicrobianos terapéuticos disponibles—incluso a agentes considerados como último recurso.7,51 La AMR es un desafío público en crecimiento a nivel mundial que fue identificada como una de las 10 principales amenazas para la salud mundial por la Organización Mundial de la Salud (OMS) en 2019.52 De acuerdo con un análisis reciente, entre 2000 y 2015, el consumo global de antibióticos aumentó 65%, de 21.100 a 34.800 millones de dosis diarias definidas (DDD), mientras que la tasa de consumo de antibióticos incrementó 39%, de 11.3 a 15.7 DDD por 1000 individuos al día durante el mismo período. Si esta tendencia continúa sin disminuir, se estima que el consumo global de antibióticos en 2030 será 200% mayor que los 42.000 millones de DDD estimados para 2015.53
Durante los últimos 30 años, la AMR ha ido en aumento, especialmente en ambientes de atención sanitaria,51 a pesar de que no se han desarrollado nuevas clases de antibióticos y a ninguna clase nueva de antibióticos se le ha otorgado la aprobación regulatoria desde finales de 1980.7,54 Los antibióticos actuales se han vuelto ineficaces en los últimos 20 años.51 Principalmente debido a un uso clínico inapropiado y al uso incorrecto de antimicrobianos, los microorganismos han adquirido resistencia a los medicamentos que ha dado como resultado el término conocido como “resistencia bacteriana epidémica”.55,56 El uso inapropiado de antibióticos representa el factor más importante en la propagación de microorganismos resistentes a medicamentos.57 Con la tasa de aumento actual, se estima que la AMR podría matar a un estimado de 10 millones de personas por año, lo que representa un gasto en la región de US$100–200 billones a nivel mundial hacia 2050.58 La investigación reciente ha demostrado que a una de cada tres personas se le administrará un antibiótico en un año, y que al menos el 20% de estas prescripciones son inapropiadas.59 En 2015, se estima que la AMR fue la causa de más de 50.000 muertes anuales en Europa y en EEUU, y se proyectó que hacia el año 2050 podría alcanzar los 10 millones.60 El costo para el sistema de salud de EEUU sólo por infecciones resistentes a antibióticos está entre US$21.000 y US$34.000 millones cada año.61 De acuerdo con la OMS, la AMR podría llegar a ser una catástrofe mundial en muy poco tiempo, y muchas personas podrían quedar incapacitadas o morir por la complicación de una simple infección.62
Los microorganismos resistentes identificados hasta la fecha abarcan un espectro de bacterias que son responsables de, y que exacerban a muchas de las enfermedades. La OMS ha identificado a los principales patógenos que requieren nuevos antibióticos (Cuadro 3).
| Prioridad | Patógeno |
|---|---|
| Crítica | Acinetobacter baumannii resistente a carbapenem, Pseudomonas aeruginosa resistente a carbapenem, y Enterobacteriaceae resistente a carbapenem que producen ESBL |
| Alta | Enterococcus faecium resistente a vancomicina, Staphylococcus aureus resistente a meticilina, intermedio a vancomicina y resistente, Helicobacter pylori resistente a claritromicina, Campylobacter resistente a fluoroquinolona, Salmonellae resistente a fluoroquinolona, y Neisseria gonorrhoeae resistente a cefalosporinas y fluoroquinolona |
| Media | Streptococcus pneumoniae no susceptible a penicilina, Haemophilus influenzae resistente a ampicilina, y Shigella resistente a fluoroquinolona |
ESBL: beta-lactamasas de amplio espectro
Resistencia antimicrobiana en heridas
Generalmente, las causas de la generalización de MDRO son varias pero el uso inapropiado de antibióticos representa el factor más importante.57 Las consecuencias directas de las infecciones con MDRO incluyen una duración mayor de la enfermedad, aumento de la mortalidad, períodos de hospitalización mayores e incremento en los costos.63,64 Los antibióticos son frecuentemente prescritos para pacientes con infecciones no bacterianas,65 lo que aumenta la presión en la selección del antibiótico y en los MDRO.66 Los tratamientos para la infección de heridas que no involucran el uso de antibióticos, antimicrobianos o antisépticos son esenciales para promover las prácticas de AMS.67
Los productos que ofrecen un método alternativo para el manejo de una carga bacteriana cada vez mayor en las heridas de difícil cicatrización, tales como los apósitos con un modo de acción físico, son efectivos para el manejo de la biocarga de la herida debido a que no hay riesgo de que las bacterias desarrollen resistencia.68,69 Una reciente declaración de buenas prácticas sobre las estrategias para el manejo de heridas para AMS indica que, para el manejo de la infección, los apósitos que no contienen componentes activos/farmacéuticos, y que por el contrario tienen un modo de acción físico para reducir la carga bacteriana, ofrecen una opción ideal para promover las prácticas de AMS.70 Una herida es una lesión que involucra cualquier alteración en la integridad de la piel. Para prevenir la pérdida de sangre y sellar la herida contra la entrada de contaminantes externos, es necesaria una respuesta de cicatrización rápida de la herida, después de lo cual el proceso de cicatrización continúa para restablecer la función tisular normal.71 Las heridas agudas (por ejemplo, por cirugía o trauma) sanan a través de una serie de pasos secuenciales y coincidentes; las fases inflamatoria, proliferativa y de remodelación.72,73 Las heridas de difícil cicatrización no sanan apropiadamente ni progresan a estas fases secuenciales de cicatrización.74
Todas las heridas abiertas de la piel son colonizadas por bacterias adquiridas, ya sea del huésped (microorganismos comensales) o por el ambiente externo.75 Generalmente, las heridas causan un ambiente cálido, húmedo y nutritivo que promueve la proliferación bacteriana, y el nivel de biocarga varía de acuerdo con la magnitud de la presencia bacteriana en la herida.76 Los microorganismos de la herida también pueden persistir en heridas de difícil cicatrización en forma de biofilm—una comunidad sésil y compleja de microbios fijados a la superficie de una herida que es tolerante al tratamiento (incluyendo a los antibióticos) y a la defensa del huésped.77,78,79 Particularmente en las heridas de difícil cicatrización, como las úlceras, que pueden agravarse dependiendo de la situación (por ejemplo, los procesos de la enfermedad subyacente del paciente), la presencia persistente de altos niveles de bacterias pueden contribuir significativamente a la naturaleza crónica de estas heridas.80,81,82
La biocarga, así como la virulencia de los organismos, la acción en sinergia de diferentes especies bacterianas y la capacidad del huésped para generar una respuesta inmune, determina la transición de contaminación a colonización e infección.83,84 La infección no puede predecirse por la presencia de un tipo específico de microorganismo o por la cantidad de bacterias,85 y la respuesta de inmunidad del huésped tiene un papel fundamental para determinar si ocurre una infección de la herida.86
La infección de la herida es un problema significativo tanto en las heridas agudas (quirúrgicas) que provocan SSI como en las de difícil cicatrización:68
Las heridas de difícil cicatrización pueden tardar semanas (o meses) en cicatrizar,102 y requieren tratamientos antimicrobianos de amplio espectro.25,103 Algunos profesionales de la salud consideran que la terapia con antibióticos debe continuarse hasta que ocurra la cicatrización, pero no hay evidencia para respaldar esta creencia.104 Además, debido a que existe el riesgo de que las infecciones recurran, comúnmente los pacientes son expuestos a varios esquemas de terapias con antibióticos.7 Debido a que las heridas de difícil cicatrización son tejidos que se inflaman fácilmente y que, por lo tanto, podrían parecer infectadas cuando en realidad no lo están, se podría dar una prescripción inapropiada/sobreprescripción de antibióticos para heridas tanto infectadas como no infectadas, lo cual puede provocar infecciones resistentes a antibióticos.105
La amenaza de la AMR en heridas ha sido reconocida por más de 20 años106,107 y en muchas especies de bacterias (Staphylococcus, Pseudomonas, Peptoniphilus, Enterobacter, Stenotrophomonas, Finegoldia y Serratia) han sido identificadas en heridas de difícil cicatrización.108Pseudomonas aeruginosa y Staphylococcus aureus son resistentes a la meticilina y particularmente prevalentes en heridas de difícil cicatrización,109 quemaduras110 y SSI.111
El uso inapropiado de antimicrobianos es común para todas las especialidades, pero hay algunos problemas que son específicos del cuidado de la herida: la infección puede ser difícil de diagnosticar en heridas de difícil cicatrización; no existen lineamientos para el tratamiento de heridas de difícil cicatrización infectadas; es posible que los profesionales de la salud no sepan exactamente cuándo utilizar antibióticos o desconozcan que su uso incorrecto podría causar un resultado perjudicial; y los pacientes podrían exigir la prescripción de una terapia antibiótica innecesaria.112 La infección mantiene la inflamación y contribuye principalmente con el retraso en la cicatrización de heridas de difícil cicatrización.83 La identificación de microorganismos en una herida de difícil cicatrización no necesariamente confirma la presencia de infección.112 El diagnóstico de infección se basa en las características clínicas más que en una prueba diagnóstica confiable,112 y estos signos de infección pueden variar dependiendo de la patología subyacente.113
Tolerancia antimicrobiana
La tolerancia ha sido definida como la capacidad de la bacteria para sobrevivir a la exposición de antibióticos sin desarrollar resistencia.114 También se ha reportado que la tolerancia invariablemente precede a la resistencia a antibióticos, lo que indica que la prevención de la tolerancia podría ofrecer un nuevo abordaje para controlar la resistencia a antibióticos.114 Este mecanismo de tolerancia ha sido asociado con infecciones crónicas persistentes.115,116 A pesar de que la resistencia antibiótica es inducida genéticamente a través de mutaciones o de transferencia genética horizontal, la tolerancia a antibióticos involucra la supervivencia bacteriana por medio de células que permanecen “dormidas”117 y por los estados fenotípicos del biofilm.118 Aunque el biofilm no entra en la definición actual de AMS, el mayor conocimiento, ubicuidad y consecuencias ambientales del biofilm entre los profesionales de la salud es fundamental para mejorar las prácticas de higiene, además de controlar la aparición y propagación de la resistencia a antibióticos en centros de salud.119
Protección antimicrobiana
Recientemente, han aparecido varias iniciativas cuyo propósito es abordar el problema de la AMR.120 AMS es una iniciativa global para combatir la AMR y así reducir el uso de antibióticos prescritos.121 En general, protección puede definirse como la planificación y el manejo responsable de un recurso7 en el que un programa de AMS exitoso (ASP, por sus siglas en inglés) optimiza el uso de antimicrobianos para mejorar los resultados del paciente a través de un programa con base en los conocimientos y las prácticas actuales.122 Un AMS exitoso debe basarse en el esfuerzo de un equipo multidisciplinario para la atención global del paciente que dé como resultado la selección y uso oportunos y óptimos de agentes antimicrobianos (Cuadro 4). Particularmente, se ha identificado que los enfermeros y las enfermeras tienen un papel fundamental en la aplicación de protección a los pacientes.123,124,125 El principal objetivo es lograr los mejores resultados clínicos para el paciente,7 y los Centros para el Control y la Prevención de Enfermedades (CDC, por sus siglas en inglés) simplifican el AMS como “pacientes que obtienen los antibióticos correctos, en el momento correcto, durante el período de tiempo correcto”.126 A pesar de que se ha demostrado que los ASP son exitosos para reducir costos, hay poca evidencia de calidad que confirme su efectividad para reducir la resistencia a antibióticos.127,128 La efectividad de los ASP para reducir las infecciones resistentes a antibióticos ha sido variable,129,130,131,132 y se requiere un mayor esfuerzo para alcanzar los beneficios de los ASP para reducir la incidencia de microorganismos resistentes a antibióticos. Una revisión Cochrane recientemente actualizada, basada en más de 200 estudios de diferentes ámbitos, encontró que la implementación de AMS en hospitales da como resultado un mayor cumplimiento de los lineamientos del tratamiento, una reducción de la duración total del tratamiento antimicrobiano, y mejores períodos de hospitalización sin que se afecte de forma adversa la mortalidad del paciente.133 Otra revisión sistemática y los metaanálisis realizados por Schuts et al.134 respaldaron la aplicación de varias implementaciones de AMS, incluyendo el uso de antimicrobianos empíricos basado en lineamientos, desescalación, cambio de terapia intravenosa por terapia oral, restricciones antibióticas, monitoreo terapéutico y consultas de cabecera en términos de lograr una mejora en los resultados del paciente, reducción de costos y aparición de eventos adversos. A pesar de las evidentes ventajas y beneficios, el manejo de programas de AMS exitosos en instituciones de salud es un desafío importante en general, y lo es aún más en ambientes con recursos limitados.135
| Evitar prescribir antimicrobianos cuando no estén indicados |
Adaptado de Dryden et al., 2011147
Protección antimicrobiana en el cuidado de heridas
Las consecuencias de la infección de la herida clínicas, económicas y relacionadas con el paciente producen una mayor carga sobre los sistemas de salud.136,137 La infección es una de las complicaciones más frecuentes de las heridas de difícil cicatrización y puede contribuir a ampliar el tiempo necesario para que estas heridas cicatricen.138 Por lo tanto, es importante generar soluciones efectivas para la infección de la herida. Se han publicado varios documentos de consenso y lineamientos que ayudan a los profesionales de la salud a tomar decisiones apropiadas para el uso de antibióticos.7,8,11,139 Debido al reconocimiento de la AMR como un problema significativo, los AMS se están convirtiendo rápidamente en una práctica común dentro del área de especialidades del manejo de la herida. La British Society for Antimicrobial Chemotherapy y EWMA publicaron un artículo que resalta al AMS como esencial para el uso apropiado de antimicrobianos (incluyendo a antibióticos), la mejora los resultados de los pacientes, la reducción de la resistencia microbiana y la disminución de la propagación de infecciones provocadas por MDRO.7,140 Este artículo concluye que la evidencia disponible es limitada, pero sugiere que la aplicación de los principios de AMS en la atención de pacientes con heridas debería ayudar a reducir el uso innecesario de terapia antibiótica sistémica o tópica, y a asegurar la terapia más segura y más clínicamente efectiva para heridas infectadas.7 La protección antimicrobiana debe incluir la consideración del uso tanto de antibióticos como de antisépticos, pero la mayor parte de la información y de los lineamientos que discuten los principios de la protección antimicrobiana no logran distinguir entre estos dos grupos de antimicrobianos.24
Con el reconocimiento cada vez mayor de la importancia de AMS en el cuidado de heridas, han surgido varias iniciativas para reducir la amenaza de la AMR:
Limitaciones
Esta revisión es una narrativa, y aunque los revisores pueden resumir y hacer comentarios sobre una recopilación de los estudios, estas revisiones no incluyen el análisis de la potencia (o ausencia) de la efectividad de una intervención. La calidad de la revisión narrativa puede mejorarse utilizando metodologías de revisión sistemáticas que ayuden a reducir el sesgo en la selección de artículos para revisión y utilizando una estrategia de investigación bibliográfica efectiva. Esto podría ser un método efectivo para utilizarse en un futuro próximo.
Conclusión
Los antibióticos son esenciales para tratar heridas en las que existe evidencia de infección, y en las que se requiere tratamiento para prevenir su diseminación posterior hacia tejidos profundos y el desarrollo de sepsis.33 Sin embargo, el desarrollo de AMR no sólo ha afectado el tratamiento de infecciones en general, sino también la prevención/tratamiento de heridas infectadas. El desarrollo de programas AMS ha ayudado a mitigar en cierta forma los desafíos de la AMR, pero se requieren urgentemente alternativas para los antibióticos. Los apósitos para heridas que actúan a través de la fijación bacteriana—que no involucran el uso de agentes antimicrobianos—utilizan las propiedades del material del apósito para reducir la biocarga al eliminar físicamente las bacterias, y promover así la progresión de la base de la herida. Estos apósitos para heridas muestran una eficacia clínicamente comprobada para reducir la biocarga de la herida (incluyendo los microorganismos resistentes a antibióticos), previniendo la infección de la herida y disminuyendo el uso de antibióticos con la premisa de AMS a través de un mecanismo de acción puramente físico. Se convierten, así, en una herramienta importante para combatir la AMR.
