Hay diferencias bioquímicas entre las heridas en proceso de cicatrización y las de difícil cicatricación (o crónicas). En aquellas que cicatrizan de manera esperada, la mitosis celular aumenta mientras que las citoquinas proinflamatorias y las metaloproteinasas de la matriz disminuyen.1 En las heridas crónicas, en cambio, se produce el proceso inverso. Siguiendo el mismo patrón, en las primeras, los factores de crecimiento aumentan y la respuesta celular es rápida, mientras que en las segundas, los niveles de factores de crecimiento son subóptimos y la respuesta celular senescente.2
La infección es la complicación más frecuente en las heridas con un proceso de cicatrización tórpido, ya que puede prolongar el tiempo de tratamiento y eventualmente derivar en la amputación de una extremidad o el fallecimiento del paciente, sumado a un aumento del uso de los recursos disponibles.3
Este artículo posiciona la preparación del lecho de la herida (WBP, por sus siglas en inglés) como una herramienta fundamental en el manejo de las heridas de todo tipo, destacando la importancia del proceso de limpieza del lecho y de la piel perilesional, así como su transversalidad en el proceso de valoración y tratamiento de una persona con una herida (Figura 1). El análisis de la evidencia disponible permitirá a enfermeras/os y médicas/os dedicados al manejo avanzado de heridas aplicar un enfoque crítico y reflexivo en la toma de decisiones vinculadas a los cuidados de la piel.
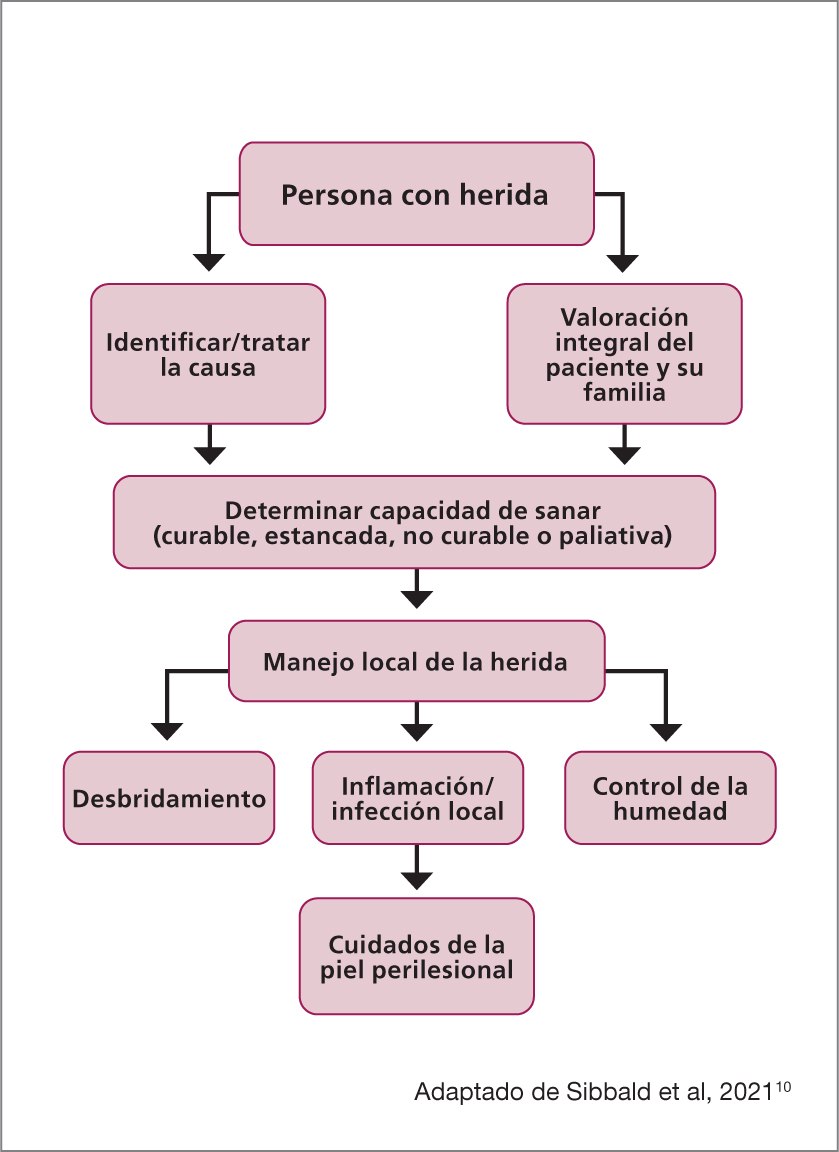
Preparación del lecho de la herida
Una herida ocurre cuando hay una pérdida de epidermis con una base dérmica o más profunda, que altera la integridad de la piel.4 Las heridas pueden ser de etiología vascular, traumática, inflamatoria, infecciosa o maligna.2
El proceso de cicatrización activado a partir del daño producido se describe, por lo general, como una sucesión de eventos independientes. Estos se pueden entender como un conjunto de cuatro fases solapadas e interconectadas, dependientes de la activación y acción celular que estimulan el crecimiento, la reparación y la remodelación del tejido y que, a su vez, permiten el restablecimiento de las características físicas, mecánicas y eléctricas que favorecen las condiciones normales del tejido.5 Este proceso está determinado por la continuidad de cada una de las fases que lo caracteriza (hemostasia, inflamación, proliferación y remodelación). Cuando se presenta una alteración que entorpece su desarrollo en el tiempo considerado como “normal” (de cuatro a sesis semanas)6 se genera una herida crónica, la cual presenta un detenimiento o retraso en la fase de inflamación o en la fase proliferativa, asociado a factores intrínsecos y extrínsecos propios del paciente, y a las alteraciones bioquímicas que estos puedan generar.7
La medicina basada en la evidencia es definida como “la integración de la experiencia clínica individual y la mejor evidencia externa”.8 En concreto, los tres pilares de la medicina basada en la evidencia incluyen: evidencia científica, conocimientos de expertos, y preferencias de los pacientes. Estos pilares se incorporan en el paradigma de preparación del lecho de la herida.
La preparación del lecho de la herida busca optimizar el tratamiento de las heridas crónicas. Es un enfoque holístico que examina el tratamiento de la causa y las preocupaciones del paciente, considerando un abordaje estructurado en el tratamiento de las heridas y el proceso de cicatrización. Si bien en América latina el término “preparación del lecho de la herida” no está ampliamente difundido, fue publicado por primera vez en 20009 y ha tenido actualizaciones periódicas en 2003, 2006, 2011 y 2015, y una nueva versión en 202110 que tiene una estrecha relación con los principios definidos en TIME. El acrónimo TIME consiste en la valoración local del lecho de la herida según cuatro parámetros: tejido no viable, infección o inflamación, humedad o exudado, y manejo de bordes.11 Una publicación posterior utiliza el concepto TIMERS, que suma las nociones de “regeneración” y “factores sociales”.12
El consenso de 20152 propone que el manejo local de la herida es sólo uno de los puntos a abordar al momento de gestionar la atención integral del paciente. Esta valoración debe incluir también la clasificación de las heridas y distinción entre aquellas con capacidad real de cicatrizar, las estancadas, y aquellas sin capacidad de cicatrizar:
- Una herida con capacidad de cicatrizar cuenta con un adecuado suministro de sangre y puede sanar si se aborda la causa subyacente
- Una herida estancada tiene potencial de cicatrización, pero también tiene barreras propias del paciente o del sistema sanitario que comprometen la cicatrización, como comorbilidades no compensadas, falta de adherencia al tratamiento, o falencias en políticas públicas y recursos sanitarios limitados
- Una herida de tipo paliativa no tiene real capacidad de cicatrizar debido a causas irreversibles o enfermedades asociadas, como isquemia crítica o neoplasia no tratable. En las heridas sin capacidad real de cicatrizar, debe adoptarse un enfoque relativamente conservador, que puede incluir desbridamiento no traumático del tejido desvitalizado, reducción de la carga bacteriana y control de la humedad.2
El consenso de 202110 de preparación del lecho de herida estableció 10 sugerencias para realizar este abordaje:
- Tratar la causa de la herida
- Centrar las preocupaciones en el paciente
- Determinar la capacidad de la herida de curar
- Monitorear el historial y examen físico (cuidado local de la herida)
- Desbridar la herida con un control apropiado del dolor
- Evaluar y tratar la infección/inflamación
- Controlar la humedad
- Evaluar el progreso en la curación
- Cuidar los bordes con terapias para heridas estancadas, con potencial de curación
- Generar apoyo organizacional (una cultura que favorezca la educación interdisciplinaria y la atención centrada en el paciente, así como protocolos estandarizados basados en la evidencia y una dotación de personal adecuada).
Estas recomendaciones buscan un enfoque activo y proactivo en el tratamiento de heridas, evaluar al paciente de manera integral y generar estrategias que promuevan una atención costo-efectiva.10
En base a estas directrices, se desprende que una correcta preparación del lecho de la herida debería considerar, además de la valoración holística de la persona:
- Reducción de la carga bacteriana y la biopelícula (biofilm)
- Eliminación del tejido no viable o desvitalizado
- Modulación del exudado
- Gestión de las disfunciones celulares y los desequilibrios bioquímicos presentes en la herida, lo cual se encuentra estrechamente relacionado con la adecuada limpieza del lecho y la piel perilesional.
Limpieza del lecho de la herida
El principio de preparación del lecho de la herida está estrechamente vinculado a los acrónimos TIME y BBWC (cuidado de heridas basado en el biofilm, por sus siglas en inglés). Ambos promueven la mantención de un lecho de la herida saludable a través de la limpieza terapéutica de la misma, y la eliminación del biofilm y del tejido necrótico y no viable mediante el desbridamiento.13
El objetivo de la limpieza de la herida es promover la curación a través de una mejor evaluación, remover materia extraña (restos de apósitos, biofilm, esfacelo, exudado y detritus) y rehidratar el lecho de la herida. El control del tejido no viable es importante, ya que este actúa como un sustrato para los microorganismos, proporcionando un foco de infección y exacerbando la respuesta inflamatoria que impide la cicatrización de la herida14 y genera consecuencias para el paciente y el sistema sanitario.
Independientemente del nivel de carga bacteriana presente, las heridas deben limpiarse en cada cambio de apósito. Es importante aclarar que irrigar una herida no es lo mismo que limpiarla. La limpieza terapéutica de la herida involucra:15
- Aplicar una solución limpiadora con potencial de romper el biofilm y eliminar bacterias planctónicas y otros microorganismos
- Resguardar la seguridad tanto de la herida como del paciente
- Uso en diversos entornos (atención primaria, secundaria y terciaria; residencias de adulto mayor; entorno doméstico)
- Irrigar a una presión adecuada
- Favorecer la mantención y protección de la piel perilesional.
No se ha establecido de forma concluyente el agente limpiador ideal ni el método óptimo de limpieza de heridas, pero se sugiere que la irrigación con soluciones antisépticas para el tratamiento local de heridas infectadas se realice según una juiciosa evaluación previa.15
Soluciones limpiadoras: infección local
La práctica de la limpieza de heridas o gestión antiséptica de la herida tiene una historia dicotómica que vincula tradición y ciencia. Es una parte integral del tratamiento de las heridas agudas, así como de las heridas crónicas.16 No existen pruebas diagnósticas que permitan a los profesionales de la salud identificar la carga bacteriana presente en una herida, y si esta es capaz de provocar infección. Por eso, se cree que todas las heridas deben someterse a alguna forma de limpieza para reducir la carga bacteriana a niveles que puedan ser manejados por las defensas del huésped.17
Además, es fundamental limpiar la piel perilesional para eliminar otras fuentes de contaminación. Debe limpiarse la piel situada a 10–20cm alrededor de la herida, ya que la piel circundante puede contener restos compuestos por lípidos, fragmentos de células queratinizadas, sebo y sudor, en los que se encuentran pequeñas cantidades de electrolitos, lactato, urea y amoníaco, que crean el entorno ideal para la proliferación de los microbios y la formación del biofilm.18
El término “antimicrobiano” se refiere a desinfectantes, antisépticos y antibióticos.19 Los desinfectantes son sustancias recomendadas por el fabricante para aplicar en un objeto inanimado con el fin de eliminar los microorganismos; no son para uso interno. Algunos desinfectantes en concentraciones más bajas se utilizan como antisépticos (por ejemplo, el hipoclorito de sodio).2 Los antisépticos, en cambio, tienen el potencial de desempeñar un papel importante en el control de la carga biológica de las heridas, limitando al mismo tiempo la exposición a los antibióticos y reduciendo el riesgo de una mayor resistencia a los mismos.20 Por último, frente a la ausencia de signos sistémicos de infección de la herida, el tratamiento local con antisépticos, tensoactivos y apósitos antimicrobianos puede ser suficiente.
Tras el desbridamiento, se han recomendado antimicrobianos tópicos para prevenir (o al menos retrasar) la adhesión de los microbios planctónicos y eliminar cualquier dispersión. La Tabla 1 resume las opciones tópicas para la infección de heridas.
Tabla 1: Soluciones limpiadoras13
| Solución | Tipo | Citotoxicidad | Efectividad sobre el biofilm | Otras características |
|---|---|---|---|---|
| Solución salina | Isotónica | Cero | Ninguna | Solución estéril, no antiséptica |
| Agua bidestilada | Hipotónica | Cero | Ninguna | Solución estéril, no antiséptica |
| Agua de la llave (potable) | Variable según componentes | Indeterminada/variable | Ninguna | No estéril |
| Polihexametileno biguanida (PHMB) | Tensoactivo antimicrobiano | Baja | Las cualidades de los tensoactivos interrumpen la adhesión del biofilm | Disponible en presentación de gel y solución de irrigación. No favorece la resistencia bacteriana |
| Dihidrocloruro de octenidina (OCT) | Tensoactivo antimicrobiano | Las pruebas in vitro muestran una alta toxicidad. La falta de absorción sugiere que no hay efectos sistémicos. No se ha demostrado que interrumpa la cicatrización | Previene la formación de nuevo biofilm durante al menos tres horas. Inhibe el crecimiento del biofilm planctónico y bacteriano hasta 72 horas | Disponible en preparaciones de gel y solución para irrigar que pueden usarse juntas o por separado. Disminuye la tensión superficial del líquido y permite una mayor extensión que facilita la separación del tejido no viable |
| Soluciones super-oxidadas de ácido hipocloroso (HOCl) e hipoclorito de sodio | Antiséptico | Puede variar dependiendo de las concentraciones | Penetra rápidamente en el biofilm, matando las formaciones desde el interior. No favorece la resistencia bacteriana | Propone una actividad antimicrobiana que favorece el desbridamiento. Disponible en preparaciones de gel y solución para irrigar que pueden usarse juntas o por sí solas |
| Povidona yodada | Antiséptico | Moderada/alta (dependiendo de su concentración) | Inhibe el desarrollo de nuevo biofilm y elimina colonias jóvenes. Reduce colonias maduras de biofilm | Modula niveles de radicales libres |
Las soluciones limpiadoras han evolucionado desde 1915, con la creación de la solución de Dakin. Esta solución (una mezcla diluida de hipoclorito de sodio, el principal ingrediente del cloro de uso doméstico)21 ha formado parte del arsenal para el cuidado de las heridas por más de un siglo. En los años siguientes, se desarrollaron muchas otras soluciones antisépticas tópicas, incluyendo la bacitracina, clorhexidina, cloruro de benzalconio (amonio cuaternario), agentes con yodo, y peróxido de hidrógeno, entre otros. Pero su uso se ha vuelto controversial en los ultimos 10 años, debido a que muchos antisépticos son citotóxicos para los queratinocitos y fibroblastos, y pueden perjudicar la cicatrización de las heridas.22,2
Seguridad en el uso de soluciones limpiadoras
Los antisépticos tópicos no son selectivos y pueden ser citotóxicos si no se administran en la herida de forma controlada. Esto significa que pueden matar las células de la piel y de los tejidos que intervienen en la cicatrización (por ejemplo, neutrófilos, macrófagos, queratinocitos y fibroblastos), perjudicando así el proceso de cicatrización. La citotoxicidad puede depender de la concentración,15,19 ya que algunos antisépticos en bajas concentraciones no son citotóxicos.
Los antisépticos se utilizan con frecuencia para reducir el exudado y controlar la carga bacteriana. Al igual que con las heridas curables, deben utilizarse soluciones con un potencial mínimo de citotoxicidad. Algunas soluciones antisépticas son más citotóxicas para los fibroblastos que otras soluciones, y aunque la toxicidad suele ser menor in vivo, el impacto puede aumentar en heridas que no cicatrizan.2
La Tabla 2 compara el nivel de citotoxicidad de las soluciones. Aquellas con tres asteriscos son las de mayor potencial de generar citotoxicidad en los tejidos, por lo tanto, su uso debería reservarse para circunstancias específicas, y sopesando el riesgo de una infección de la herida frente al riesgo de retrasar la cicatrización.
Tabla 2: Agentes antisépticos según grado de citotoxicidad2
| Agente antiséptico | Efecto |
|---|---|
| Suero fisiológico/agua bidestilada* | No citotóxico. Sin efecto bactericida |
| Clorhexidina o PHMB** | Baja citotoxicidad. Amplio espectro. No incluye esporas. Efecto antibiofilm (CHG sólo por acción mecánica) |
| Povidona yodada** | Citotoxicidad moderada. Amplio espectro |
| Ácido acético (vinagre diluido al 1:5 hasta 1:10)** | Espectro de acción reducido, principalmente sobre Pseudomonas |
| Hipoclorito de sodio puro, solución de Dakin*** | Altamente citotóxico |
| Peróxido de hidrógeno (agua oxigenada)*** | Acción por efecto efervescente |
| Amonio cuaternario*** | Altamente citotóxico |
agente de baja/moderada citotoxicidad;
***agente altamente citotóxico.
PHMB: polihexametileno biguanida; CHG: gluconato de clorhexidina
Por una parte, se encuentra la familia de biguanidas. En el mercado latinoamericano hay limpiadores en base a clorhexidina y polihexametileno biguanida (PHMB). El gluconato de clorhexidina (CHG) se ha utilizado durante más de 30 años en el ámbito clínico. En concentraciones de entre 0,5–4%, el CHG es más eficaz contra las bacterias gram positivas que las gram negativas, y tiene menos actividad contra los hongos y los bacilos tuberculosos.16 Es inactiva contra las esporas bacterianas, excepto a temperaturas elevadas.14 Numerosos estudios indican que el CHG no se absorbe a través de la piel y tiene un bajo potencial de irritación, sin embargo, existen reportes de casos de pacientes que han desarrollado hipersensibilidad a este compuesto. Sumado a esto, el CHG no debe entrar en contacto con los ojos, el oído medio o las meninges, debido a su alta toxicidad.16 El PHMB es uno de los antisépticos para heridas más utilizados en la actualidad. Su eficacia antiséptica no inhibe el proceso de reepitelización,23 sin embargo, se ha demostrado que la exposición de los osteoblastos humanos y las células endoteliales a la polihexanida a concentraciones con una actividad antibacteriana provoca graves daños celulares, lo que plantea dudas sobre la viabilidad de utilizar este tipo de antiséptico en el cemento óseo para el tratamiento de infecciones de artroplastia total.24
Por otro lado, en el grupo de soluciones súper oxidativas se encuentra la ya mencionada Dakin (hipoclorito de sodio), que presenta altos niveles de citotoxicidad y se caracteriza por un pH básico (alcalino). También dentro de este grupo, pero no mencionado en la Tabla 2, se encuentra el ácido hipocloroso (HOCl), una molécula conocida desde el siglo pasado pero con una formulación relativamente reciente, que logró estabilizar la molécula a un pH 5.5. Este pH permite que la solución sea pura, con nula toxicidad a nivel celular e inclusive favoreciendo el proceso de cicatrización, siendo tan segura para los tejidos como el suero fisiológico pero con un efecto bactericida comprobado.25 Existen soluciones limpiadoras que combinan hipoclorito de sodio y HOCI, sin embargo, estas formulaciones poseen algún grado de citotoxicidad y su pH es más bien básico.26
Si bien la Tabla 2 lista los antisépticos que se han utilizado desde hace más de 100 años, muchos antisépticos antiguos, como el peróxido de hidrógeno y el hipoclorito de sodio, ya no se recomiendan debido al alto riesgo de daño tisular asociado con su uso.27 La excepción es el uso para el tratamiento de heridas en entornos de recursos limitados, en los que no siempre se dispone de antisépticos alternativos contemporáneos.13
Ácido hipocloroso puro pH 5.5
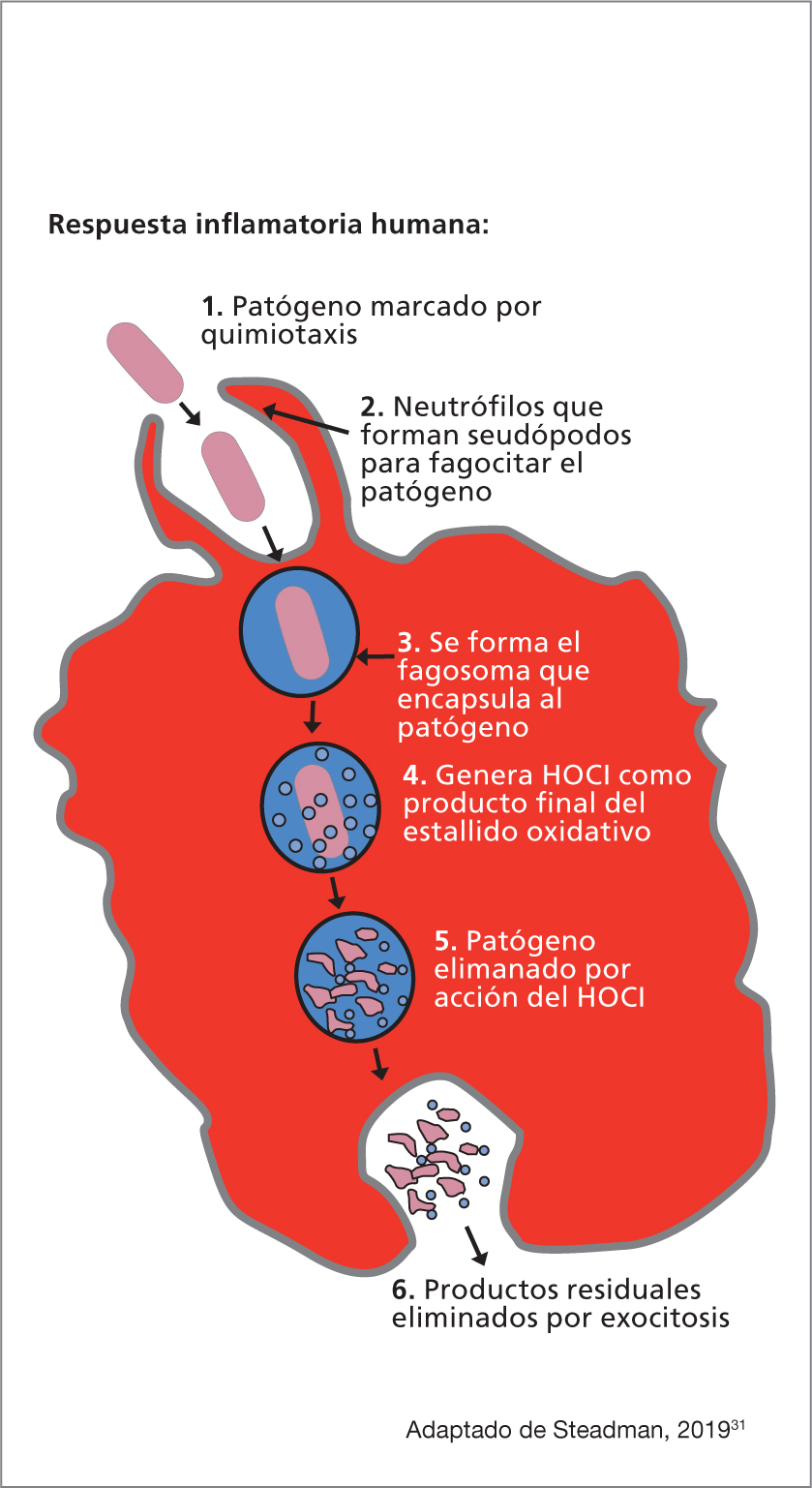
El HOCI, descubierto en 1834,28 es una molécula que se produce de forma natural en los neutrófilos humanos como producto del estallido oxidativo, el cual le otorga el nombre de solución superoxidada. La función de los neutrófilos es encontrar y fagocitar (es decir, destruir) microorganismos invasores. Tras la fagocitosis, el HOCI se transforma en N-clorotaurina, una molécula que puede proporcionar una actividad antimicrobiana in situ y que sirve de antiséptico único y natural, producido y gestionado in vivo en el cuerpo humano.29,30
Como principal defensa contra los microbios patógenos invasores, el HOCl destruye bacterias, hongos, y sus esporas y virus dentro del cuerpo humano como parte de la respuesta inflamatoria innata (Figura 2).31 Un estudio demostró que el HOCl puro pH 5.5 disminuye el nivel tisular de bacterias en heridas crónicas granuladas y permite que la cicatrización de la herida se lleve a cabo sin ninguna citotoxicidad.26 Se ha demostrado que el HOCI es bactericida, fungicida, virucida y con eficacia frente a esporas.32 Hasta la fecha, no se ha reportado resistencia al compuesto, irritación de la piel, sensibilidad o toxicidad oral u ocular.32
Hasta hace unos 10 años, el desarrollo del HOCl como solución antiséptica se vio probablemente limitado por las dificultades para mantener la estabilidad de la solución una vez almacenada.26 Distintas formulaciones de HOCI han sido elaboradas recientemente y están disponibles en el mercado latinoamericano e internacional. Sin embargo, dado que el HOCI es un ión no disociado del cloro y oxígeno dependiente, no todas las soluciones cuentan realmente con una formulación que resguarde la estabilidad de esta molécula, que coexiste en muchos casos con variados porcentajes de hipoclorito de sodio o cloro y, por ende, con los efectos citotóxicos de estas moléculas.
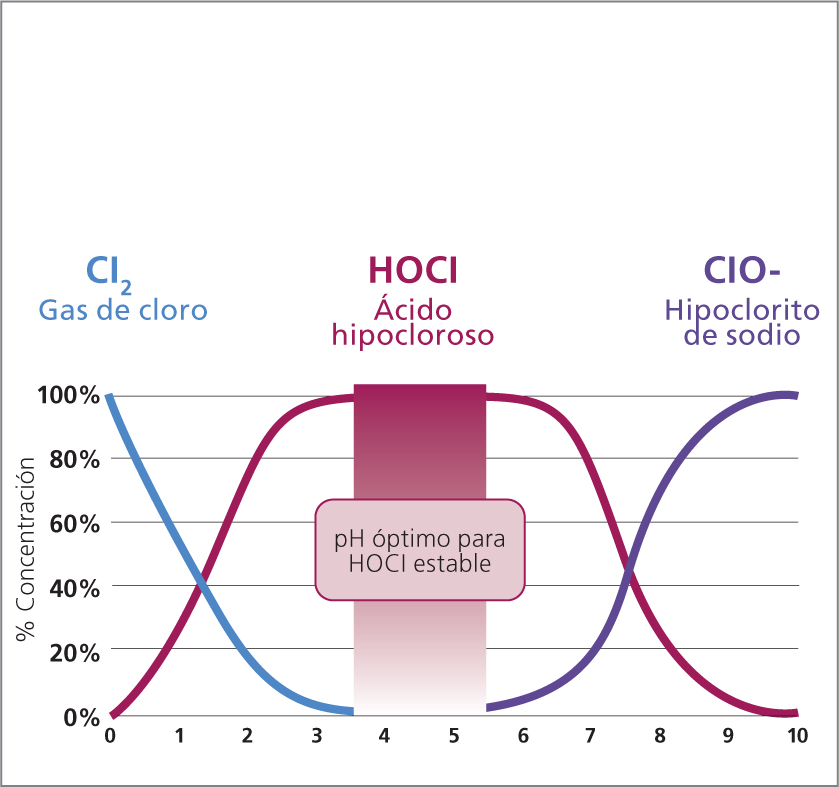
La estabilidad del HOCI es dependiente del pH. El HOCI puro sólo existe en el rango de pH aproximado de 3.5 a 5.5. A medida que la solución se vuelve más ácida y el pH cae por debajo de aproximadamente 2–2.5, el átomo de cloro se disocia, y da como resultado la formación de gas de cloro. En el otro extremo del espectro, cuando el pH del HOCI es superior a 5.5, el HOCI se disocia o degrada, pierde su átomo de hidrógeno y forma el anión hipoclorito (ClO-). El HOCI se convierte completamente (100%) en hipoclorito de sodio a un pH de 9.5–10, y en un 80% aproximadamente a un pH de 8.0 (Figura 3).25 Estos cambios de pH generan una pérdida de propiedades de HOCI que aumentan la citotoxicidad y disminuyen la acción antimicrobiana.33
Efectos bactericida y antibiofilm
A diferencia de los microorganismos planctónicos, los fenotipos que desarrollan biofilm se han definido como agrupaciones estructuradas de células microbianas agregadas, rodeadas por una cápsula mucopolisacárida que se adhieren a superficies naturales, artificiales, o a sí mismas.34
En estudios de microscopía realizados en biopsias de heridas crónicas (úlceras de pie diabético, úlceras venosas y lesiones por presión) se observó que el 60% de las muestras contenía estructuras de biofilm en comparación con sólo el 6% de biopsias realizadas de heridas agudas.35 Dado que el biofilm se considera un importante factor causante de múltiples enfermedades inflamatorias crónicas, es probable que casi todas las heridas crónicas tengan un grado de biofilm, al menos, en una parte del lecho de la herida, siendo estos microorganismos con fenotipo de biofilm quienes contribuyen a que se establezca una respuesta hiper inflamatoria, perjudicial para el huésped.36,37,38 Otros estudios sugieren que el biofilm bacteriano en las heridas crónicas puede promover la hipoxia tisular localizada, reduciendo la disponibilidad de oxígeno necesaria para la cicatrización de la herida.39
Se ha demostrado que el HOCI puro pH 5.5 posee una acción antimicrobiana en un corto tiempo de acción (15 segundos), actuando en un amplio espectro de microorganismos (hongos, esporas y bacterias resistentes a fármacos). El HOCI actúa a través de diversos mecanismos, tales como la alteración de la permeabilidad de la pared celular y de la membrana celular, alterando la síntesis de ADN y provocando una asfixia en las bacterias.32,40 Sin embargo, como se mencionó anteriormente, cuando las heridas están asociadas con biofilm pueden no parecer clínicamente infectadas, conteniendo altos niveles de patógenos dentro de esta matriz (mucopolisacárida) que dificulta la acción de agentes bactericidas. Una vez establecido, el biofilm suele ser muy tolerante a los paradigmas de tratamiento y eliminación habituales como el desbridamiento mecánico, por lo que, al momento de decidir qué solución limpiadora utilizar, resulta esencial considerar su capacidad de eliminar el biofilm y evitar su reformación, que puede ocurrir dentro de las siguientes 24 horas.38
El HOCI puro pH 5.5 está recomendado para limpiar, facilitar el desbridamiento y tratar heridas, incluidas las infectadas y las asociadas con la presencia de biofilm.8 El HOCl es capaz de lograr una ruptura física del biofilm, con una eficacia comprobada entre 3 y 5 minutos luego de aplicarse en el lecho de la herida (reducción > log6 UFC/cm3).41 Además de promover un efecto antimicrobiano y evitar la reformación del biofilm, favorece el desbridamiento como un coadyuvante para facilitar este procedimiento a través de otras técnicas menos dolorosas y/o más rápidas, como el desbridamiento cortante, quirúrgico, ultrasónico o electrostático, entre otros. Esto permite dedicar menos tiempo al proceso de limpieza y de curación en general y, por tanto, es una alternativa costo-efectiva de implementar.42,43,44 Finalmente, en estudios como el de Dharap et al.45 se demostró que el HOCl proporciona mejoras significativas en el tamaño de la úlcera y manejo de la infección, así como una reducción significativa de los signos de inflamación.
Beneficios en el proceso de cicatrización y en la piel perilesional
El pH de la piel tiene la característica de ser ácido en la mayor parte de la superficie, con un valor cercano a 5.5, el cual se va acidificando desde el momento del nacimiento de manera gradual hasta formar una barrera contra los patógenos. Su alteración constituye un factor de riesgo para infecciones u otras complicaciones, ya que el manto ácido permite la existencia de una flora bacteriana residente y es una barrera para la flora de tipo transitoria.46
Cuando se pierde la continuidad de la barrera de la piel y se genera una herida, es necesario lograr un óptimo proceso de cicatrización donde se deben conjugar varios factores, dentro de los cuales resalta el rol del pH ácido y el cuidado de la piel perilesional, siendo este último uno de los elementos que se valoran en TIME.11 Favorecer un pH ácido es, por tanto, un pilar en el conjunto de factores a evaluar y abordar para favorecer la curación de una herida. Una revisión realizada para analizar los beneficios de la cicatrización en un entorno ácido evidenció que ayuda en la cicatrización de la herida controlando la infección, aumentado la actividad antimicrobiana, alterando la actividad de las proteasas, liberando oxígeno, reduciendo la toxicidad de los productos finales bacterianos y mejorando la reepitelización y angiogénesis.47, 48
A nivel microbiológico, el HOCI tiene la capacidad de oxidar el aminoácido taurina e inducir la formación de cloro-taurina, que tiene un efecto protector sobre los tejidos ya que puede inhibir la producción de mediadores inflamatorios.49 Además, Sakarya et al. demostraron que la solución de HOCl mejora la cicatrización de las heridas en contraste con la povidona yodada.50
Seguridad en poblaciones especiales
Debido a las características anteriormente mencionadas, el HOCI puro pH 5.5 ha demostrado ser seguro y efectivo en la limpieza y como parte del tratamiento local de úlceras de pie diabético (UPD), úlceras venosas (UV), lesiones por presión (LPP) y heridas quirúrgicas, independiente de la carga bacteriana presente en ellas. Su efecto bactericida de amplio espectro y en un corto tiempo de acción, sumado al efecto antibiofilm y facilitador del desbridamiento, han demostrado excelentes resultados descritos en la literatura internacional.25,41
Sumado a estos usos, la seguridad y citotoxicidad cero del HOCI puro y su pH 5.526 han permitido su uso en poblaciones con características especiales (adultos mayores, población pediátrica y neonatal), así como en lesiones complejas (por ejemplo, quemaduras intermedias) o en cavidades como solución de irrigación para prevenir infecciones y tratar lesiones mucosas.25,30 Donde el uso de otras soluciones se encuentra contraindicado, debería ser evaluado si el beneficio de sus efectos bactericidas y antibiofilm son mayores al efecto perjudicial que se generaría sobre el tejido sano y/o en formación.
El HOCI puro pH 5.5 ha demostrado importantes beneficios como parte del tratamiento de lesiones de piel en pacientes pediátricos, siendo una de ellas la dermatitis asociada a incontinencia (DAI), que es la principal causa de lesiones de piel en esta población de pacientes.51 Publicaciones de casos clínicos de tratamiento con HOCI puro pH 5.5 con indicación de uso diario evidencian la recuperación de la barrera cutánea en niños críticamente enfermos y con DAI.42
Otro tipo de lesiones que se producen tanto en la población adulta como pediátrica son las LPP y las lesiones por dispositivos médicos, que pueden presentar complicaciones severas como la infección de tejidos profundos. Hay reportes de casos clínicos de pacientes con lesiones por dispositivos médicos severas, donde se llevó a cabo un protocolo de tratamiento con HOCI puro pH 5.5 y se evidenció una recuperación de la indemnidad de la piel en ocho semanas.52 Otra serie de casos clínicos de pacientes con LPP categorías III y IV donde se utilizó HOCl pH 5.5 como solución limpiadora evidenció la existencia de una mejoría en relación al área, volumen y calidad del tejido presente en el lecho de la herida en todos los casos. Además, las heridas permanecieron libres de olor e infección durante el manejo con el protocolo mencionado.53
Seguridad en el paciente quemado
El grupo de pacientes quemados es una de las poblaciones especiales de gran interés debido a la pérdida de la función de barrera de grandes extensiones de piel. La infección es una de las principales complicaciones, por lo que el uso de elementos que reduzcan la carga bacteriana de forma profiláctica es parte del estándar de cuidado y cicatrización.54
La limpieza de este tipo de lesiones se ha realizado históricamente con soluciones inocuas, como la solución salina, o a través de estrategias de limpieza más agresivas, como el uso de jabón de clorhexidina. En el contexto del paciente quemado, prevenir y/o tratar la infección es prioritario y ha justificado el uso de agentes con algún grado de citotoxicidad.55 Por eso, el uso de soluciones limpiadoras plantea nuevas posibilidades en relación al manejo y prevención de la infección sin interferir en el proceso de cicatrización. Es necesario evaluar ciertas características antes de seleccionar la solución a utilizar, como ser segura para el paciente, no generar dolor o ardor (considerando que son heridas que pueden tener un daño superficial o profundo en la piel), y no generar irritación/hipersensibilidad u otro tipo de alteración metabólica (toxicidad) al ser absorbida por el cuerpo.54 A su vez, debe lograr prevenir efectivamente la infección, por ser esta una de las principales complicaciones en el manejo de quemaduras.
Considerando lo anteriormente mencionado y en base a la evidencia disponible, el HOCI puro pH 5.5 sería seguro de utilizar en el manejo de quemaduras en pacientes adultos y pediátricos. Es efectivo en la prevención de la infección, y puede facilitar el desbridamiento y favorecer la cicatrización sin generar resistencia ni hipersensibilidad. Además, se han estudiado sus beneficios en el cuidado de injertos como solución de irrigación, donde logró controlar la carga bacteriana de forma segura y efectiva.56
Un estudio que comparó al HOCI puro pH 5.5 con un limpiador antimicrobiano de uso regular en un centro de salud evidenció una mejoría en el manejo del dolor, un buen nivel de seguridad para prevenir infección, y mayor costo-efectividad del HOCl puro pH 5.5 sobre la solución alternativa.56 Otro estudio analizó una serie de casos de heridas complejas, entre ellas quemaduras, y demostró una evolución favorable en todos los pacientes donde se utilizó el HOCI puro pH 5.5 como tratamiento coadyuvante con presión negativa; además, ninguno de los casos presentó signos de infección en las heridas.57 Sería interesante explorar otras áreas de estudio en relación con nuevas indicaciones y beneficios de su uso, por ejemplo, en etapas prequirúrgicas como solución de preparación de la piel.
Discusión
Debido al perfil de seguridad y efectividad del HOCI puro pH 5.5, se han desarrollado estudios recientes sobre su uso en la prevención de infecciones del sitio quirúrgico. Un estudio de serie de casos de prótesis de cadera y rodilla utilizó irrigación con HOCI antes del cierre quirúrgico y, luego, en el sitio de sutura de la cirugía. Ningún paciente presentó infección del sitio quirúrgico, ni se evidenció crecimiento microbiano en la toma de cultivos.58
También se ha usado HOCI puro pH 5.5 en el tratamiento de presión negativa con instilación en cirugías de fascitis necrotizante en pacientes críticamente enfermos, que mejoró la calidad del tejido, favoreció el cierre, y evitó complicaciones severas, como amputación o muerte.55,56,57,58,59,60,61,62 En un estudio de serie de casos de cirugías abdominales en pacientes con cuadros sépticos, se usó HOCI para irrigación y lavado intestinal, que ayudó a disminuir la carga microbiana, prevenir nuevas infecciones y favorecer la regeneración de los tejidos.63,64
Un panel de expertos en cirugía plástica y dermatología analizó el uso del HOCI puro pH 5.5 en la preparación de la piel para procedimientos, así como en el cuidado y tratamiento posterior de la herida quirúrgica.65 Concluyeron que el HOCI ofrece un entorno óptimo para el proceso de cicatrización, ayuda a disminuir la generación de cicatrices hipertróficas (por su efecto inmunomodulador) y, a diferencia de la clorhexidina, se podría utilizar en la preparación antiséptica del rostro, ya que el HOCI puro no es óculo/ototóxica.65
Conclusión
La preparación del lecho de la herida es una herramienta ampliamente desarrollada y revisada durante los últimos años, y de gran importancia al evaluar y tratar heridas de todo tipo. Su valor radica en proporcionar un enfoque holístico y sistemático en el abordaje y manejo avanzado de las heridas.
Los cuidados basados en la evidencia (CBE) brindan un estándar de calidad a la atención que se otorga a los diversos usuarios del sistema de salud. Las estrategias que optimizan el proceso de reparación de los tejidos evolucionan constantemente, y aunque el tipo de tratamiento de las heridas requiere de un plan individualizado para cada una de ellas, la limpieza del lecho es una actividad transversal.
La limpieza de la herida es reconocida como un paso fundamental de la preparación del lecho de la herida. Por eso, se ha intensificado la búsqueda y elaboración de soluciones limpiadoras con el potencial de promover la curación mediante la eliminación de barreras locales, sin comprometer el tejido sano y/o en formación. Diversos tipos de limpiadores de heridas han tenido históricamente características que limitan su uso (por ejemplo, el uso repetitivo y en exceso de antisépticos sin indicaciones adecuadas). Sin embargo, cuando se utilizan en los momentos y concentraciones adecuadas, algunas clases de soluciones limpiadoras antisépticas pueden proporcionar una herramienta para que el tratante impulse el lecho de la herida según los objetivos establecidos.
En el caso de los limpiadores de heridas, existe un debate entre la citotoxicidad y las actividades celulares, que busca la efectividad sin comprometer la seguridad del lecho de la herida o del paciente.
Las soluciones de HOCl puro con pH 5.5 se han probado en la prevención y el tratamiento de la infección en varios tipos de heridas. Según los estudios in vitro, la actividad antimicrobiana parece ser comparable a la de otros antisépticos, con el beneficio de que estas soluciones no perjudican la cicatrización de la herida e incluso pueden mejorarla, además de resolver la infección. Es seguro, no es citotóxico, favorece el proceso de cicatrización y posee efectos positivos en la piel perilesional, siendo el más natural de los limpiadores de heridas, al estar compuesto por la misma molécula con la cual el propio sistema inmune responde a los patógenos.66
Se están explorando nuevos usos y beneficios del HOCI puro pH 5.5 en poblaciones especiales y heridas de difícil manejo, a través de estudios. Aunque es necesaria una exploración de mayor rigurosidad científica, la evidencia disponible da señales de ser un agente revolucionario en la gama de soluciones limpiadoras y protagonista en un cambio de paradigma tanto en el tratamiento y prevención de la infección, como en los cuidados integrales de la piel y su cicatrización.

