Históricamente, la piel ha sido considerada un órgano pasivo de protección; sin embargo, con el pasar de los años, se han descubierto múltiples interacciones inmunológicas que hicieron que, hoy, se la considere el mayor órgano inmune.1 Las quemaduras son definidas como la respuesta local y sistémica de la piel ante un agente térmico, que ocasiona una respuesta inflamatoria, y que activa todos los mecanismos de defensa.2,3 Generalmente, en una lesión cutánea, se desencadena una respuesta inmune con fines protectores. En cambio, en el pioderma gangrenoso (PG), la reacción inflamatoria es exagerada y causa lesiones dérmicas ulcerosas de difícil curación. Esta condición de hiperreactividad dérmica es conocida como el fenómeno de patergia.4
El PG fue descrito por primera vez en 1924 como la gangrena postoperatoria de Cullen, quien observó lesiones ulcerosas de borde eritematoso y violáceo, con necrosis central.5 En 1930, Brusting, Goeckman y O’Leary la denominaron PG, por sospechar que la úlcera necrosada y dolorosa se debía a una infección por estreptococos.6 Hasta la fecha, no se conoce claramente su etiología, pero se han propuesto múltiples teorías que involucran alteraciones en la inmunidad humoral y celular, defectos en la quimiotaxis, migración de neutrófilos, hipergammaglobulinemia y alteraciones genéticas.7
Se trata de un padecimiento poco frecuente, caracterizado por lesiones cutáneas, ulceradas, coalescentes, dolorosas, destructivas, recurrentes y no infecciosas, localizadas en cualquier parte del cuerpo (predominantemente, en miembros inferiores), con secuelas cicatrizales significativas.4,7 Pueden presentarse en múltiples variantes: clásica, ampollosa, pustulosa, vegetativa, secundaria a fármacos, o periostomal.8 Entre 50 y 70% de los casos, de PG están asociados con enfermedades sistémicas, como enfermedad inflamatoria intestinal, artritis reumatoide, síndromes mieloproliferativos, y gammapatías.9,10 En al menos 50% de los casos, se observa el fenómeno de patergia, secundario a lesiones cutáneas de origen traumático, como accidentes de tránsito, quemaduras, heridas postquirúrgicas e, incluso, lesiones menores, como la administración de vacunas o canalización venosa.4,5,6,7 Es una patología de difícil diagnóstico y, por lo general, se realiza por exclusión después de descartar otras patologías cutáneas de origen infeccioso, vascular o neoplásico.
La biopsia de la úlcera cutánea frecuentemente describe infiltrado inflamatorio abundante de predominio neutrofílico, pero este hallazgo no es patognomónico de la enfermedad.11,12 Las manifestaciones clínicas pueden ser:
Los datos epidemiológicos precisos en el PG son limitados, debido a lo infrecuente de su presentación.6 La mayoría de la información se basa en reportes de casos, series y estudios de cohortes. Su incidencia varía, y se reportan de 3 a 10 casos por millón de habitantes al año.6,8,9 Aunque puede aparecer en cualquier edad, suele presentarse entre los 20 y 50 años, y se ha reportado hasta en un 4% en niños asociado con enfermedades sistémicas o inmunosupresoras con lesiones en glúteos, la región genital y perianal, y la cabeza, áreas extrañas en el paciente adulto.6 No hay preferencia de género,8,12 pero algunos reportes muestran una prevalencia mayor en mujeres.6 La asociación del PG con el trauma térmico es poco frecuente, y hay escasa evidencia documentada en la literatura.10,11
Este artículo reporta los resultados de una revisión de la literatura de casos de PG asociados con quemaduras, y los de un caso clínico de PG en un paciente con quemaduras presentado por los autores, con el fin de determinar si hay semejanzas entre el caso último y aquellos publicados en la literatura.
Método
Se realizó una búsqueda en las bases de datos médicas PubMed, ScienceDirect y ClinicalKey, utilizando las palabras claves “pyoderma gangrenosum”, “Pyoderma” y “burns” con el conector “AND” (Pyoderma gangrenosum AND Burns). La revisión abarcó desde junio de 2006 hasta julio de 2020, ya que la primera asociación clínica de PG con quemaduras fue descrita en 2006.4 La búsqueda arrojó 831 artículos. Sólo 43 contaron con “pioderma” o “burns” en el título, resumen y palabras claves especificadas por el autor. Como criterios de inclusión, se tuvieron en cuenta todos los reportes de casos, series y estudios de cohortes escritos en inglés y español, que describieran pacientes que desarrollaron PG después de presentar quemaduras de cualquier etiología. Las variables de estudio fueron: área anatómica de la quemadura, localización del PG, extensión y profundidad de la quemadura, causa de la quemadura, edad, género, resultado de la biopsia, tratamiento del PG, y antecedentes patológicos del paciente. Se excluyeron todas las publicaciones científicas de PG por causas diferentes a las quemaduras. Después de leer todos los resúmenes, sólo nueve artículos describieron casos de PG asociados con quemaduras, de acuerdo con los criterios de inclusión.
Caso de estudio
Paralelamente, los autores realizaron un caso clínico sobre una mujer de 16 años, que presentó una quemadura por llama con 18% de la superficie corporal total (SCT) comprometida, y una profundidad mixta de espesor parcial superficial y profunda en cara, pabellones auriculares, cuello, tórax anterior, extremidades superiores y muslo izquierdo, y pequeñas áreas de espesor total en el cuello y tórax anterior.
La paciente ingresó en cuidados intensivos de la Unidad de Quemados, dentro de la Unidad de Servicios de Salud (USS) Simón Bolívar Subred Norte, en Bogotá, Colombia, en marzo de 2020. Fue por una lesión de la vía aérea, que requirió manejo con nebulizaciones con budesónida. A las 48 horas, una vez estabilizada su condición general y habiendo firmado el consentimiento informado, se le practicó dermoabrasión mecánica bajo anestesia general en las áreas superficiales, y escarectomía tangencial temprana en las áreas más profundas. En la cara, se realizó una cobertura temporal con membrana amniótica, que quedó expuesta hasta su epitelización. Ocho días después de la escarectomía, se realizó una cobertura definitiva con injertos autólogos de piel parcial tomados de la cara interna del muslo izquierdo, con una integración del 100%. A los 10 días, la paciente fue dada de alta. Su tratamiento continuó con curaciones ambulatorias, que incluyeron gasas impregnadas con nitrofurazona y Triticum vulgare cada 48 horas, por presentar pequeñas áreas cruentas en proceso de epitelización en los bordes de las áreas injertadas.
A los 19 días, la paciente reingresó en la unidad debido a esfacelación y secreción purulenta abundante en las áreas que se encontraban previamente sanas e injertadas, en el cuello y tórax anterior (Figura 1a). Se realizó lavado, desbridamiento quirúrgico y enjertación de las nuevas áreas cruentas, con una integración del 100%. Siete días luego de la enjertación, se le dio el alta nuevamente (Figura 1b). Pero, 13 días después de su segundo egreso, la paciente reingresó por presentar nuevamente esfacelación parcial de las zonas injertadas y epitelizadas, con lesiones ulceradas coalescentes de gran tamaño (entre 1 y 1,5cm de diámetro), secreción purulenta abundante y fétida, y dolor intenso en las lesiones de cuello y tórax anterior (Figura 2a), que fueron aumentando de tamaño hasta formar un área cruenta de mayor extensión: 18 x 18cm (Figura 2b). Se realizó un diagnóstico clínico de sobreinfección bacteriana, se tomaron cultivos y se inició un tratamiento con cefalexina sin presentar mejoría. Los cultivos de secreción fueron reportados como negativos.

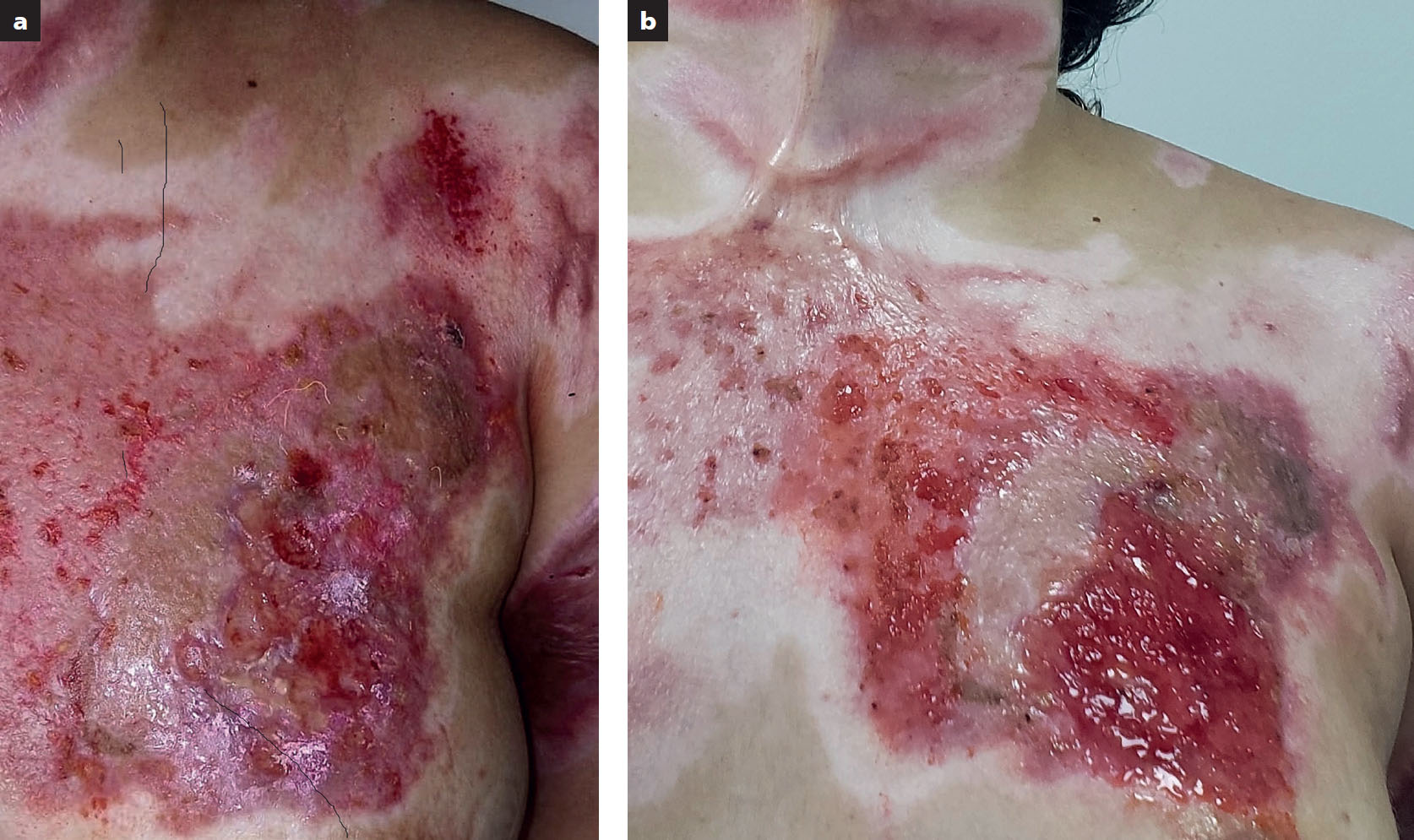
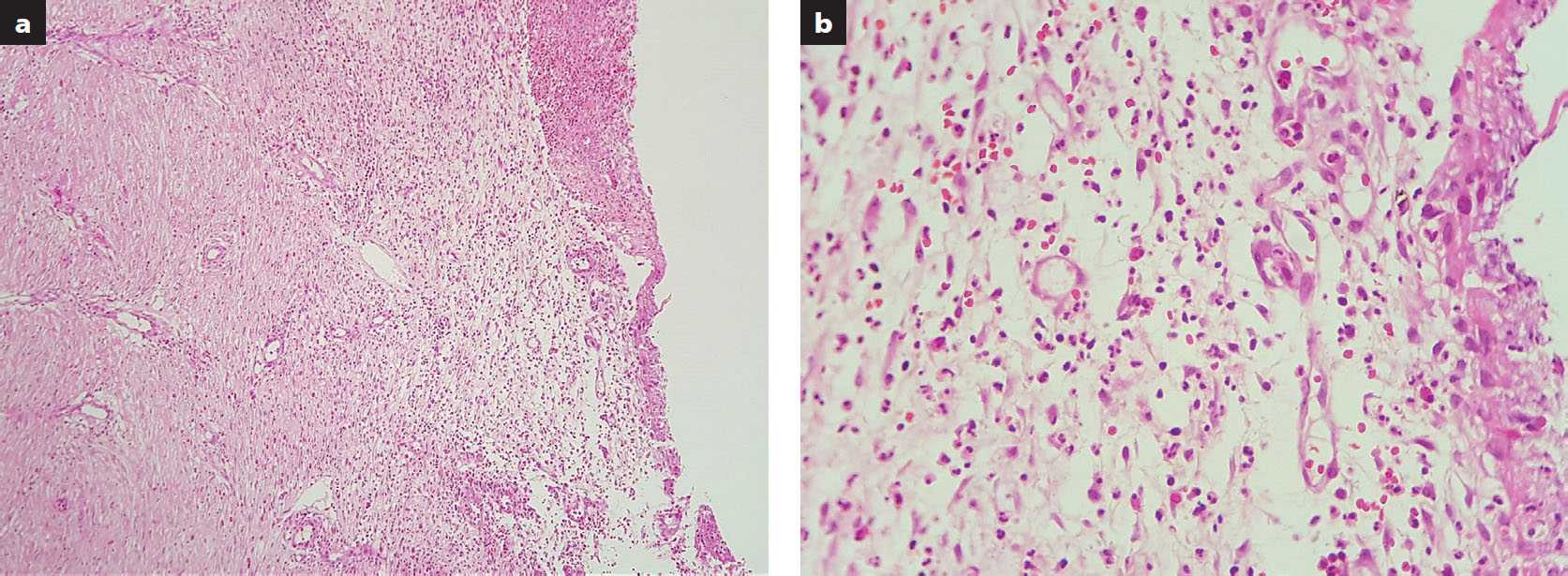
Ante la evolución tórpida, cronicidad y aumento de lesiones, se solicitó la valoración del servicio de dermatología, cuyo equipo tomó una biopsia del tórax anterior y reportó infiltrado inflamatorio abundante de predominio neutrofílico, sugestivo de PG (Figura 3). Se inició un tratamiento con prednisolona vía oral (10mg diarios por siete días), con la recomendación de diferir nuevos procedimientos quirúrgicos hasta 20 días después del tratamiento.
A los cinco días de haberse iniciado la terapia con corticoides, la paciente comenzó a evolucionar satisfactoriamente. Hubo una reducción del 50% en el tamaño de las zonas cruentas, y se continuó con curaciones ambulatorias hasta lograr la epitelización completa de sus lesiones. Dichas curaciones se realizaron cada 48 horas, e incluyeron un lavado exhaustivo con 1000 a 1500cc de solución salina normal para retirar completamente secreciones, costras, tejido necrótico, material de curaciones, e hiperqueratosis (presente en los bordes de la herida). Post lavado, se realizó una cobertura con gasas impregnadas con nitrofurazona, Triticum vulgare y, como apósito secundario, un vendaje voluminoso o acolchado elaborado por la USS Simón Bolívar Subred Norte, ya que es difícil conseguir en el mercado el tamaño de vendaje necesario para este tipo de heridas. A los 15 días, se observó una reducción del 70% de la herida con varias áreas cruentas residuales, que se trataron de forma expuesta con aplicaciones de rifamicina spray 1% cada 2 a 3 horas. La epitelización completa de las lesiones se obtuvo seis días después, para un total de 21 días luego de iniciado el tratamiento inmunosupresor, sin necesidad de procedimientos quirúrgicos adicionales.
Resultados
Los nueve artículos seleccionados presentaron un total de 17 reportes de casos de PG asociados con quemaduras. Se incluyó, además, el caso de estudio realizado por los autores, y descrito anteriormente (C18). Los hallazgos clínicos de la revisión y tratamientos realizados están detallados en el Cuadro 1 (parte 1 y 2).
| Caso | Autor | Edad | Sexo | Área quemada | SCQ (%) | Etiología de la quemadura | Antecedente |
|---|---|---|---|---|---|---|---|
| C1 | Napoli et al.4 | 65 | F | Pierna | SD | Hielo sintético | No |
| C2 | Gaviria et al.9 | 45 | M | Cara | 2% | Química | Pioderma gangrenoso |
| C3 | Gaviria et al.9 | 36 | M | Extremidad superior e inferior, y tronco | 30% | Llama | No |
| C4 | Kosaraju y Duggirala10 | 18 | F | Cara, cuello, tórax anterior, brazos, y pierna izquierda | 15% | Llama | No |
| C5 | Obradovic et al.12 | 24 | F | SD | 40% | Líquido hirviendo | No |
| C6 | West et al.14 | 74 | M | Hombro | 2% | Contacto con radiador | Dermatitis |
| C7 | West et al.14 | 57 | F | Cara, cuello, tórax anterior, y piernas | 45% | Llama | No |
| C8 | Kalu y Williams5 | 45 | M | Hombro izquierdo | 1% | Líquido hirviendo | Diabetes mellitus y alcoholismo |
| C9 | Matsuda et al.13 | 51 | F | Tórax, extremidad superior, y abdomen | 35% | Llama | No |
| C10 | Stair-Buchmann15 | 60 | M | SD | SD | SD | Melanoma |
| C11 | Stair-Buchmann15 | 66 | M | SD | SD | SD | Psoriasis |
| C12 | Stair-Buchmann15 | 64 | M | SD | SD | SD | Enfermedad inflamatoria intestinal |
| C13 | Stair-Buchmann15 | 65 | M | SD | SD | SD | Enfermedad inflamatoria intestinal |
| C14 | Stair-Buchmann15 | 61 | M | SD | SD | SD | Herida quirúrgica |
| C15 | Stair-Buchmann15 | 64 | F | SD | SD | SD | No |
| C16 | Stair-Buchmann15 | 63 | F | SD | SD | SD | No |
| C17 | West et al.14 | 56 | F | Cara, pabellones auriculares, brazo, y tórax | 8% | Llama | No |
| C18 | Presente estudio | 16 | F | Cara, cuello, tórax, y miembros superiores | 18% | Llama | No |
SCQ: superficie corporal quemada. SD: sin datos. PG: pioderma gangrenoso. M: masculino. F: femenino
| Caso | Localización del PG | Biopsia de piel | Tratamiento del PG | Tratamiento de la quemadura |
|---|---|---|---|---|
| C1 | Pierna | No | Metilprednisolona y prednisolona | SD |
| C2 | Cara | No | Adalimumab y micofenolato de mofetilo | Curaciones |
| C3 | Extremidad superior e inferior, tronco, y área donante | Infiltrado mononuclear abundante con neutrófilos sin vasculitis | Prednisolona y ciclofosfamida | Escarectomías tangenciales, homoinjertos, injertos de piel parcial, y CQ |
| C4 | Tronco, brazos y área donante | Infiltrado denso neutrofílico | Ciclosporina betametasona | Desbridamiento e injertos de piel |
| C5 | Miembros inferiores | Reacción inflamatoria con neutrófilos | Metilprednisolona | Injertos de piel parcial |
| C6 | Hombro | No | Esteroides tópicos | Conservador |
| C7 | Tórax y región inframamaria | No | Esteroides tópicos y ciclosporina | Desbridamiento e injertos de piel parcial |
| C8 | Hombro izquierdo | No | Prednisolona oral y tacrolimus | Conservador |
| C9 | Tronco y región temporal derecha | Infiltración neutrofílica difusa sin vasculitis | Prednisolona | Dermoabrasión e injertos de piel parcial autólogos |
| C10 | Extremidades inferiores | Infiltración granulocítica neutrofílica | Prednisolona | SD |
| C11 | Extremidades inferiores | Infiltración granulocítica neutrofílica | Prednisolona | SD |
| C12 | Extremidades inferiores | Infiltración granulocítica neutrofílica | Prednisolona | SD |
| C13 | Abdomen | Infiltración granulocítica neutrofílica | Prednisolona | SD |
| C14 | Extremidades inferiores | Infiltración granulocítica neutrofílica | No | SD |
| C15 | Extremidades inferiores | Infiltración granulocítica neutrofílica | Prednisolona | SD |
| C16 | Extre midades inferiores | Infiltración granulocítica neutrofílica | Prednisolona | SD |
| C17 | Brazo y tórax | No | Esteroides tópicos | Conservador |
| C18 | Cuello, tórax anterior y miembro superior | Infiltrado inflamatorio abundante de predominio neutrofílico Prednisolona | Prednisolona | Desbridamiento, injertos de piel parcial, y membrana amniótica |
SD: sin datos. PG: pioderma gangrenoso. CQ: cultivo de queratinocitos
La mitad de los 18 pacientes era hombre (n=9); la otra mitad, mujer. Su edad promedio fue 51,7 años, con una media de 58,5 años. Las zonas con lesiones más afectadas fueron las del miembro inferior, en el 55% de los casos (n=10); miembros superiores, en 27,8% (n=5); tórax anterior, 33,3% (n=6); cara, 11% (n=2); y cuello, 5,55% (n=1).4,14 El tratamiento más frecuentemente empleado fue con corticoides, en 88,9% de los casos (n=16/18). También, se empleó ciclosporina, en 11,1% (n=2/18) de los casos; ciclofosfamida, 5,6% (n=1); tacrolimus, 5,6% (n=1), y terapia con fármacos biológicos anti factor de necrosis tumoral (TNF, por sus siglas en inglés), 5,6% (n=1).
Discusión
El primer caso de PG relacionado con el trauma térmico fue reportado por Napoli en el hospital de Palermo, Italia, en junio de 2006,4 sobre un paciente que sufrió quemaduras por hielo sintético. Desde esa fecha hasta julio de 2020, los autores encontraron nueve publicaciones con 17 casos clínicos de PG asociados con quemaduras.4,8 De acuerdo con los datos encontrados en esta revisión, la edad de presentación varió entre los 18 y 74 años, tanto en hombres como mujeres. Sin embargo, la paciente del C18 tenía 16 años, y es posible que sea el primer caso de PG asociado con quemaduras reportado en un menor de edad.10,12
La zona anatómica más frecuentemente comprometida está en miembros inferiores y tronco.10,11En esta revisión, los pacientes presentaron múltiples lesiones en diferentes localizaciones, relacionadas con la zona corporal previamente quemada o con las áreas donantes de injertos de piel. En línea con esto, la paciente del C18 presentó múltiples lesiones localizadas en miembros superiores, cuello y tórax, todas ellas, relacionadas con las áreas previamente quemadas.
Todos los autores coincidieron en afirmar que el diagnóstico del PG es difícil, pues se asemeja a varias patologías y, por lo general, se realiza por exclusión.8,9,10 La cronicidad de las heridas y la presencia de secreción purulenta abundante hace pensar, inicialmente, en un proceso infeccioso bacteriano, el cual se descarta por los cultivos negativos. Cuando el PG se asocia con quemaduras, es normal observar múltiples lesiones ulcerosas con áreas cruentas coalescentes y con tendencia a aumentar en tamaño, que se presentan en zonas sanas previamente quemadas, con áreas totalmente epitelizadas o zonas con injertos de piel completamente integrados. Incluso, varios autores reportaron su aparición en las áreas donantes de piel.9,10
Una vez que aparecen estas lesiones, su evolución es tórpida y no mejora con el tratamiento convencional. Las curaciones se hacen frecuentes y el uso de apósitos inteligentes es ineficaz cuando no se realiza, además, un tratamiento inmunosupresor. Los procedimientos quirúrgicos, como los desbridamientos y la cobertura con injertos de piel, agravan el cuadro clínico, por el fenómeno de patergia, y se tornan de difícil cicatrización y manejo.6,7 La biopsia no es patognomónica, pero permite sospechar que se trata de un PG por la presencia de infiltrado neutrofílico abundante, sin evidencia de procesos vasculíticos o infecciosos. Este hallazgo fue consistente en todos los reportes estudiados. Otro signo indirecto a favor de un PG es la respuesta adecuada al tratamiento inmunosupresor e inmunomodulador.
Las lesiones pueden presentarse temprana o tardíamente. El caso más temprano lo reportó Kosaraju,10 con la aparición de las lesiones a los 20 días; el más tardío fue descrito por West, 50 años después de la quemadura.14 En la mayoría de los reportes, la presentación clínica comienza como lesiones ulcerosas con base necrótica, o lesiones ampollosas sobre el área previamente cicatrizada, que evolucionan hacia la esfacelación y nuevas áreas cruentas con secreción purulenta.
Con respecto al tratamiento del PG, en primera línea, se acepta el uso de inmunosupresores (por ejemplo, corticoides) y, en segunda línea, la ciclofosfamida, con evolución predominantemente positiva, junto con terapia hiperbárica para mejorar el dolor y acelerar la curación de las lesiones.15,16 Estudios recientes17 reportan nuevas terapias dirigidas, con inhibidores de interleucinas y TNF, con hallazgos prometedores. Sin embargo, la baja incidencia de la enfermedad limita los resultados definitivos. En la revisión, encontramos que el tratamiento más frecuentemente empleado fue con corticoides.
El cuidado de la herida variará de acuerdo con las características de la misma, la disponibilidad de apósitos, los tópicos disponibles, y los recursos económicos del centro de salud en cuestión, ya que el alto precio de los nuevos apósitos biotecnológicos suele ser costoso para varias instituciones. La International Society for Burns Injuries (ISBI) recomienda considerar aquellos apósitos que ayuden a prevenir contaminación, sequedad, evaporación desde la herida, y efectos mecánicos negativos.18El apósito ideal debería:
Limitaciones
Una de las limitaciones de la presente revisión es la escasez de casos reportados de PG asociados con quemaduras, y la falta de datos registrados y publicados.
Conclusión
El PG es una patología de difícil diagnóstico. Al analizar los casos de estudio reportados en esta revisión, junto con los resultados del caso clínico C18, los autores concluyeron que, cuando el PG se asocia con lesiones traumáticas, como las quemaduras, suele presentarse en áreas sanas, ya cicatrizadas. Ocurre, más comúnmente, en los miembros inferiores; no obstante, puede aparecer en cualquier área anatómica. Se puede presentar a cualquier edad, incluso en menores de edad (como se reportó en el caso C18), con mayor frecuencia en la quinta década de la vida. No se reporta prevalencia de género.
El manejo con curaciones debe realizarse frecuentemente, para mantener la zona limpia. El uso de apósitos secundarios absorbentes puede evitar la acumulación de secreciones y de humedad excesiva. Aunque se trata de un proceso no infeccioso, el uso de antibióticos tópicos puede ayudar a controlar la sobreinfección bacteriana.18
Si bien no hay un tratamiento específico, el uso de inmunosupresores (corticoides y ciclofosfamida) son los más frecuentemente utilizados al tratar PG. Recientemente, se ha propuesto el manejo con medicamentos biológicos,17 pero aún no hay suficiente evidencia científica que los respalde.
