Existen múltiples publicaciones que describen las heridas crónicas o de difícil cicatrización como un problema de salud pública, no sólo por su morbilidad y aparición frecuente, sino por su alta probabilidad de causar mortalidad en los pacientes.1,2,3,4,5
Según la literatura,6,7 aproximadamente 1% de la población mundial desarrollará una herida crónica en algún momento de su vida. No es de extrañar, entonces, que el cuidado de heridas represente entre el 2 y 4% del gasto en salud en los países en vías de desarrollo.5 En los Estados Unidos, donde unas 6.5 millones de personas tienen heridas crónicas,8 el gasto anual en el manejo de estas heridas supera US$ 20.000 millones.9,10
La presencia de microorganismos, incluso en heridas sin signos de infección local o sistémica, es reconocida como una posible causa de prolongación del tiempo de curación.11 Las bacterias en estas heridas aumentan la respuesta inflamatoria e inducen la liberación de enzimas, que digieren proteínas y pueden dañar el tejido. La inflamación, por otro lado, aumenta la permeabilidad de los vasos sanguíneos en la herida, lo cual incrementa la producción de exudado que, a su vez, puede causar dolor, expandir el tamaño de la herida, y macerar el lecho de la misma y de la piel perilesional.12,13
Cuando una herida se infecta, los microorganismos invaden y dañan los tejidos más profundos.14 Las bacterias pueden producir problemas localizados (dolor, eritema, inflamación y exudado excesivo) o provocar enfermedades sistémicas (sepsis). La infección puede convertir una herida aguda en una herida crónica, prolongar el tratamiento o los tiempos de estancia hospitalaria, y aumentar significativamente los costos de cuidado.15
Además de existir en forma libre y planctónica, los microorganismos en las heridas pueden presentarse en forma de biofilm (o biopelícula), comúnmente asociado al retraso de cicatrización de heridas.16,17
Biofilm: barrera para la cicatrización
El Centro para Control de Enfermedades (CDC) estima que 65% de todas las infecciones son causadas por bacterias con un fenotipo de biofilm. El instituto Nacional de Salud de los Estados Unidos, por su parte, calcula que el número es cercano al 80%.34 Sin embargo, el diagnóstico de la infección por biofilm representa un gran reto. Un diagnóstico definitivo requiere confirmación visual de bacterias embebidas en una sustancia polimérica, donde se utilicen métodos de imagen con microscopia electrónica o de identificación de ADN bacteriano mediante técnicas recombinantes que no están fácilmente disponibles y pueden resultar costosas.35 Por las dificultades asociadas con su diagnóstico, se desarrolló un algoritmo clínico para identificar el biofilm en el lecho de las heridas mediante signos visuales e indicadores clínicos indirectos, especificados en dicho algoritmo.36
La presencia de biofilm en una herida genera tolerancia a la mayoría de las intervenciones antimicrobianas. Además, el biofilm puede volver a formarse después de un desbridamiento37,38,39 si no es manejado con agentes antimicrobianos efectivos y apósitos apropiados que generen la disrupción de los mucopolisacáridos para, así, ejercer una acción antibacteriana sobre las bacterias expuestas.15 Es por eso que, en los últimos años, los apósitos fueron añadiendo iones de plata para aumentar su acción antibacteriana y evitar la resistencia a los antibióticos.25,26,27,28 Hoy, hay apósitos con agentes quelantes que ayudan a la disrupción del biofilm para que los iones de plata actúen sobre las bacterias. Esto podría mejorar la acción antibacteriana y prevenir la reformación del biofilm.29,30,31,32,33
Prevenir la reconstitución del biofilm en el lecho de una herida requiere evitar la reintroducción de microorganismos mediante el uso de curaciones con apósitos de barrera que permitan controlar el exudado, y usar agentes antimicrobianos para eliminar las bacterias en estado planctónico y el biofilm remanente.
Partiendo de los resultados de los diferentes estudios in vitro,40,41,42,43 in vivo16 y clínicos44 que han demostrado la efectividad de los apósitos con hidrofibra reforzada, con iones de plata al 1,2%, y agentes que logran la disrupción del biofilm, se planteó un seguimiento de casos en pacientes con heridas de difícil cicatrización y diferente etiología.
Objetivo
El objetivo de este trabajo fue evaluar la efectividad clínica y seguridad de un apósito de hidrofibra reforzada, con plata iónica al 1,2%, potenciado con ácido etilendiaminotetraacético (EDTA) y cloruro de bencetonio (Aquacel Ag+ Extra, ConvaTec Inc.) para el control de infección local, exudado y biofilm en heridas de difícil cicatrización. Otro objetivo fue evaluar la progresión de las heridas crónicas con el uso de este apósito, el control de la infección en heridas con absceso y la efectividad al momento de preparar el lecho de la herida para una cobertura quirúrgica definitiva.
Materiales y métodos
El siguiente fue un estudio prospectivo, observacional, de seguimiento de casos. La recolección de datos se llevó a cabo entre enero y diciembre de 2017, con un seguimiento de tres meses para cada caso, y realización de curaciones en el servicio de cirugía plástica, de acuerdo con la saturación del apósito utilizado.
El estudio contó con la aprobación del Comité de Ética del hospital El Tunal, en Bogotá, Colombia, y se basó en los principios éticos contemplados en la declaración de Helsinki. Todos los pacientes fueron informados sobre el propósito del estudio y firmaron un consentimiento informado. En caso de ser menores de edad, sus acudientes dieron la aprobación.
Los pacientes que participaron en el estudio fueron divididos en tres grupos:
Criterios de inclusión y exclusión
En la selección de pacientes, los siguientes criterios de inclusión fueron tomados en cuenta:
Se aplicaron, a su vez, los siguientes criterios de exclusión:
Procedimiento
Una vez valorado el paciente, se realizó el diligenciamiento de formulario de evaluación del producto, que incluyó datos de identificación del paciente, de la historia clínica, condiciones de comorbilidad, y una descripción de la/s heridas a tratar, donde se detalló el tipo de herida, localización, tamaño, tiempo de evolución, tratamientos previamente recibidos, signos clínicos de infección local, nivel de exudado, signos visuales o indirectos sugestivos de presencia de biofilm, características de la piel perilesional, y presencia de dolor de acuerdo con la escala de valor análoga (EVA).
Antes de cada curación, se tomaron fotografías usando siempre el mismo fondo y la misma distancia focal, teniendo en cuenta diferentes ángulos que permitieran identificar la ubicación anatómica de la herida.
Todas las curaciones fueron realizadas en la clínica de heridas del hospital, bajo supervisión directa de los autores. El proceso de curación, previa asepsia y antisepsia, consistió en el uso de guantes y colocación de campos estériles, lavado de la herida con solución salina 0,9%, retiro de esfacelos y material desvitalizado (a través de un desbridamiento mecánico superficial con gasas), aplicación del apósito de hidrofibra reforzado, con iones de plata al 1,2%, potenciado con EDTA y cloruro de bencetonio, como apósito primario, y cubrimiento de manera oclusiva con apósito secundario. Se realizaron curaciones de este tipo según el tamaño de la herida y la respuesta clínica, cada tres a cinco días, dependiendo del grado de saturación del apósito primario o en contacto con la herida.
Este procedimiento se repitió en cada uno de los controles, hasta completar un período de seguimiento de tres meses.
Análisis estadístico
Se registraron variables de edad y sexo; enfermedades concomitantes; localización, tamaño y duración de la herida; utilización de antibiótico previo; presencia de biofilm; porcentaje de exudado; y número de curaciones previas y requeridas durante el tratamiento. Para las variables cualitativas, se presentaron frecuencias y porcentajes; para las cuantitativas, la mediana y el rango. Se utilizó el programa Microsoft Excel para recolectar los datos clínicos de los pacientes y Epi Info como software de análisis estadístico de la base de datos.
Resultados
En total, 23 pacientes (ocho hombres y 15 mujeres) con heridas de difícil cicatrización participaron del estudio. La edad mediana fue 37 años (rango intercuartil [RIC] 20–62). De los 23 pacientes, 21 habían recibido antibióticos para el manejo de la infección antes de ingresar en el estudio. Todos los pacientes tenían, al menos, una comorbilidad (en el peor de los casos, cuatro).
Los sitios anatómicos más frecuentemente afectados fueron la pierna (n=9) y el tórax (n=4). El tiempo de evolución de las heridas fue de 0–3 meses en 18 pacientes, 3–6 meses en un paciente y más de seis meses en cuatro pacientes. El promedio de curaciones requeridas fue ocho; el de días de tratamiento, 35 (Tabla 1).
| Variable | n | % |
|---|---|---|
| Edad Me (RIC) | 37 (20–62) | |
| Sexo | ||
| Masculino | 8 | 34,8 |
| Femenino | 15 | 65,2 |
| Uso de antibióticos | 21 | 95,5 |
| Comorbilidades Me (RIC) | 1 (1–4) | |
| Localización de la herida | ||
| Cara | 2 | 8,7 |
| Tórax | 4 | 17,4 |
| Miembro superior | 2 | 8,7 |
| Abdomen | 1 | 4,4 |
| Sacra | 1 | 4,4 |
| Trocantérica | 1 | 4,4 |
| Isquiática | 2 | 8,7 |
| Muslo | 1 | 4,4 |
| Pierna | 9 | 39,1 |
| Pie | 0 | 0,0 |
| Duración de la herida | ||
| 0–3 meses | 18 | 78,3 |
| 3–6 meses | 1 | 4,4 |
| > 6 meses | 4 | 17,4 |
| Tratamiento promedio (días) | 35 (21–67) | |
| Número de curaciones | 8 (6–13) | |
Me: mediana; RIC: rango intercuartil
Tipo de heridas
En total, 10 pacientes fueron incluidos en el grupo 1 de heridas que requerían cicatrización por segunda intención. Los tipos de heridas más frecuentes en este grupo fueron las infecciones del sitio operatorio (n=4), seguidas por úlceras venosas (n=2), úlcera por presión (n=1), herida por fricción sobreinfectada (n=1), quemadura sobreinfectada (n=1) y herida en cara secundaria a resección de retinoblastoma en región orbitaria, con abundante exudado (n=1).
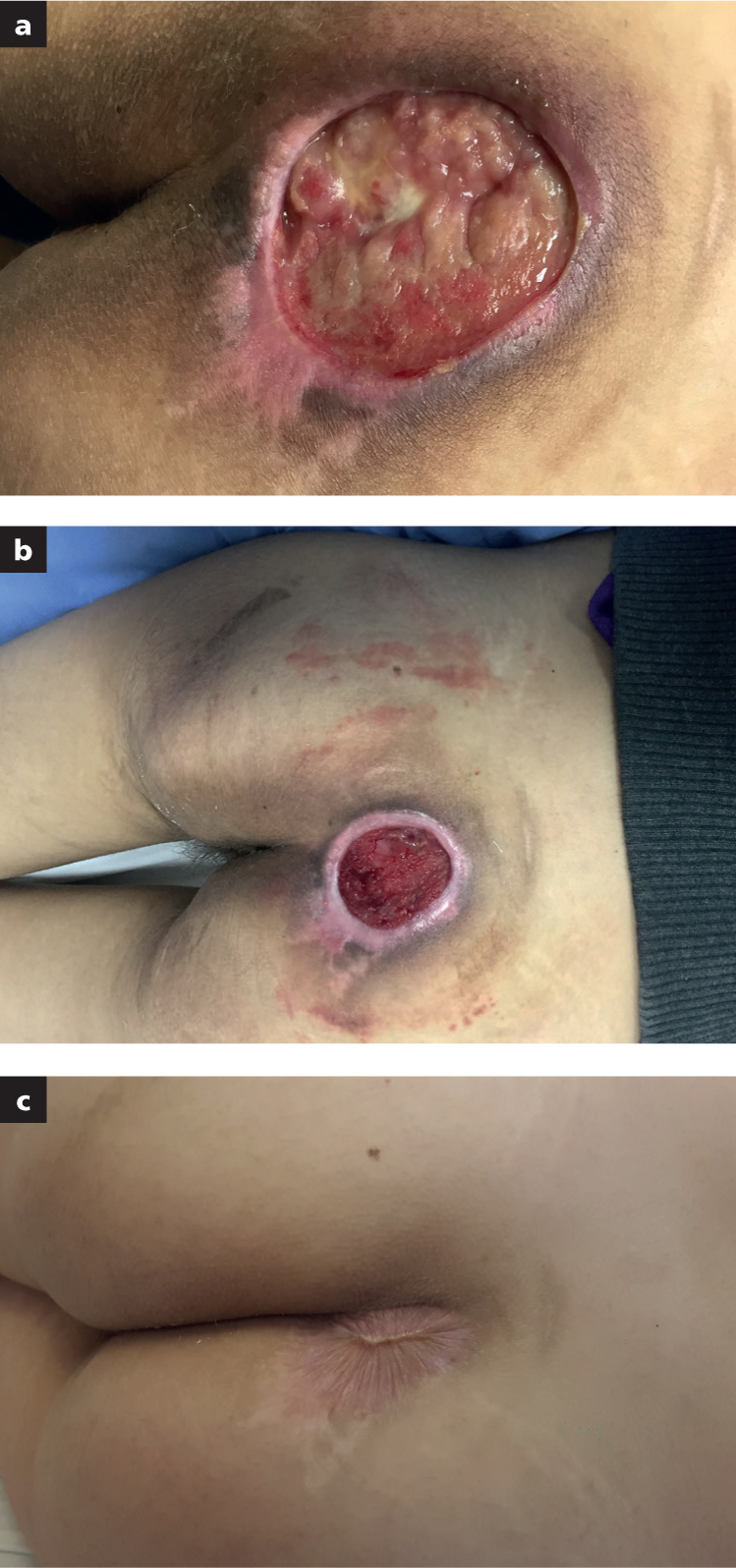
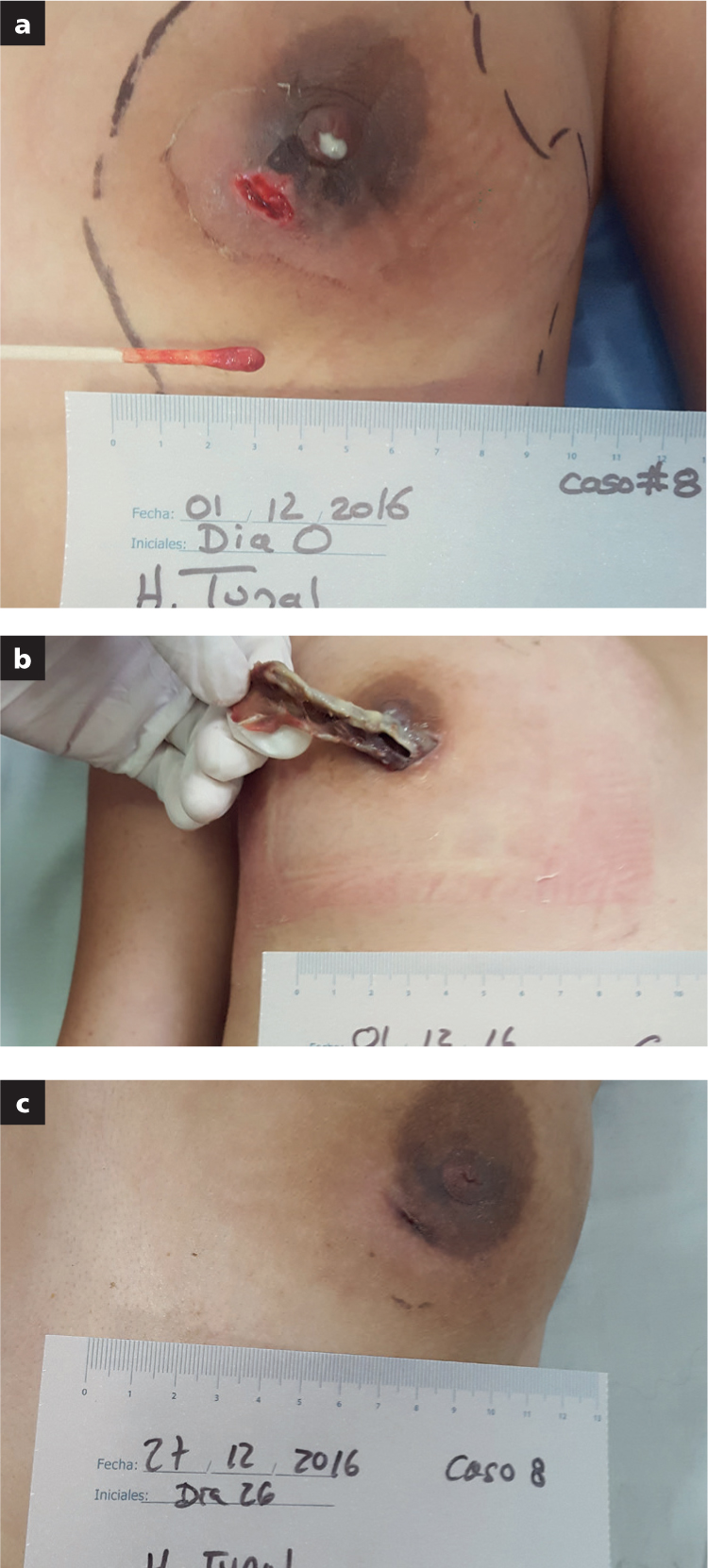
En el grupo 2, de heridas con absceso, se incluyeron dos pacientes con mastitis (n=2), herida traumática en cara con absceso (n=1) y seroma como consecuencia de resección de biopolímeros en región glútea (n=1).
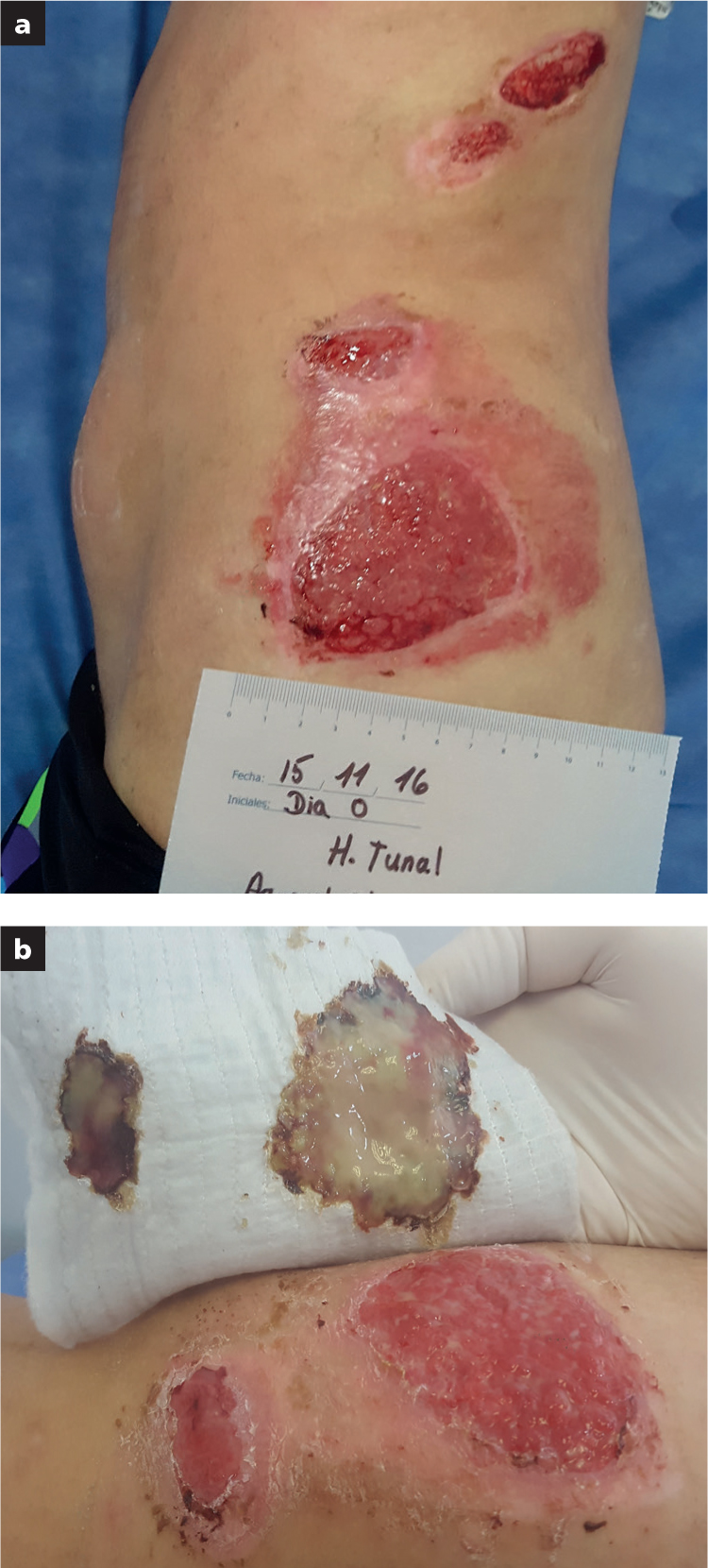
El grupo 3 contó con nueve pacientes que requerían preparación del lecho de la herida para cobertura quirúrgica. Las más frecuentes fueron las heridas de la pierna con exposición ósea, que requirieron cobertura con colgajo miocutáneo (n=5); herida en pierna para cobertura con injerto de piel de espesor parcial (n=1); úlcera arterial en pierna con exposición tendinosa, que requería preparación del lecho para cobertura con matriz dérmica acelular bicapa (n=1); úlcera por presión en región isquiática, que se preparó para cobertura con colgajo miocutáneo (n=1); y herida en antebrazo secundaria a fasciotomía por síndrome compartimental, que requería cobertura con injerto de piel de espesor parcial (Tabla 2).
| Grupo | n | % |
|---|---|---|
| 1: Heridas para cicatrización por segunda intención | ||
| Infección del sitio operatorio | 4 | 17,39 |
| Úlceras venosas | 2 | 8,69 |
| Úlcera por presión | 1 | 4,34 |
| Herida por fricción | 1 | 4,34 |
| Quemadura sobreinfectada | 1 | 4,34 |
| Herida secundaria a resección de tumor | 1 | 4,34 |
| 2: Heridas con absceso | ||
| Mastitis | 2 | 8,69 |
| Herida en cara con absceso | 1 | 4,34 |
| Seroma infectado postoperatorio, extracción biopolímeros glúteos | 1 | 4,34 |
| 3: Heridas que requieren preparación del lecho para cobertura quirúrgica | ||
| Herida en pierna con exposición ósea, preparación para cobertura con colgajo | 5 | 21,73 |
| Herida en pierna, preparación para injertos cutáneos | 1 | 4,34 |
| Úlcera arterial, preparación para cobertura con matriz dérmica acelular | 1 | 4,34 |
| Úlcera por presión isquiática, preparación para cobertura con colgajo | 1 | 4,34 |
| Fasciotomía, preparación para cobertura con injertos cutáneos | 1 | 4,34 |
Disminución de la superficie de la herida
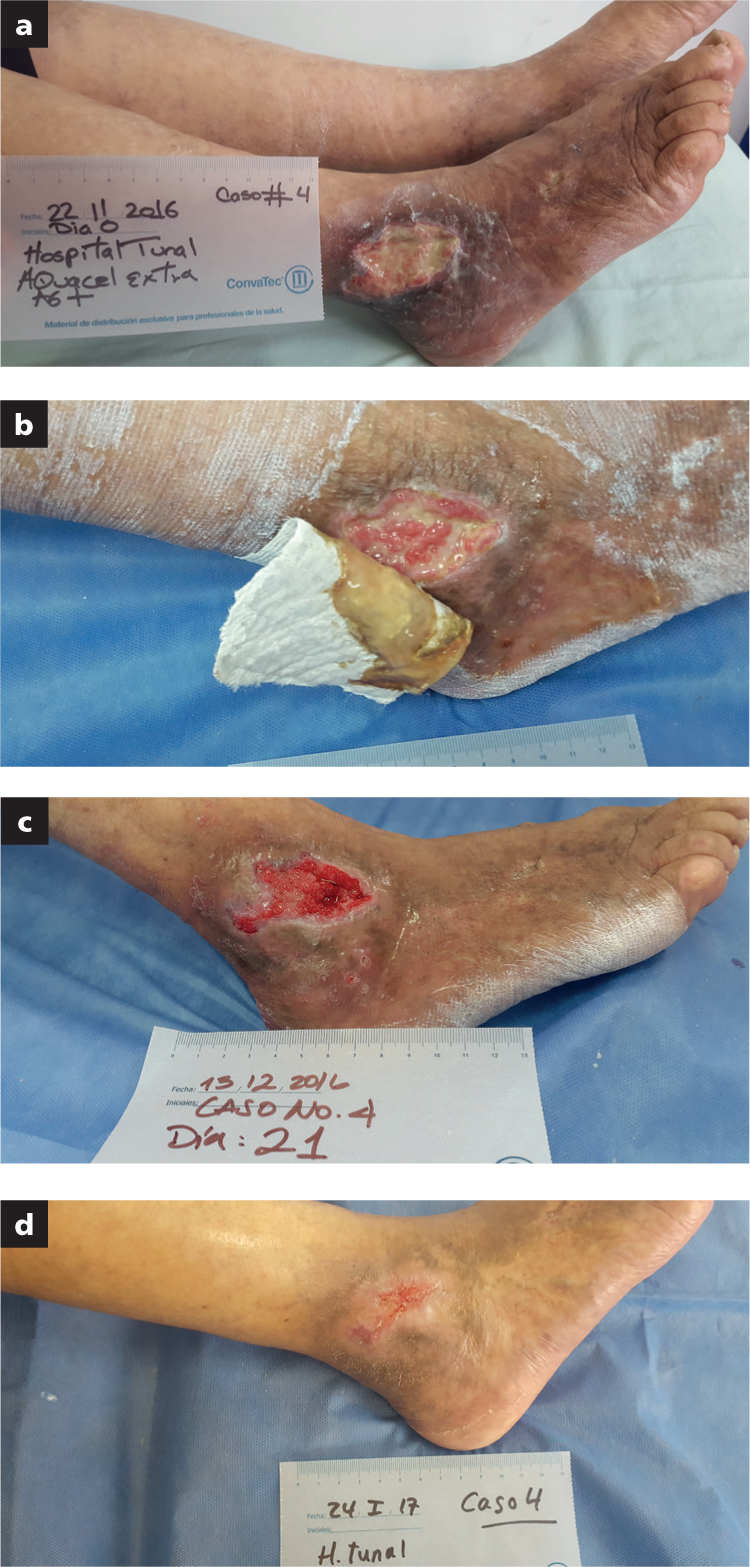
Hubo una disminución de exudado, infección y signos indirectos de biofilm, así como una reducción significativa de la superficie de la herida con cierre total en 21 casos (91,3%) y dos casos (8,69%) en donde no se logró el cierre total, pero sí una disminución de la superficie de la herida de más de 60% (Fig 1).
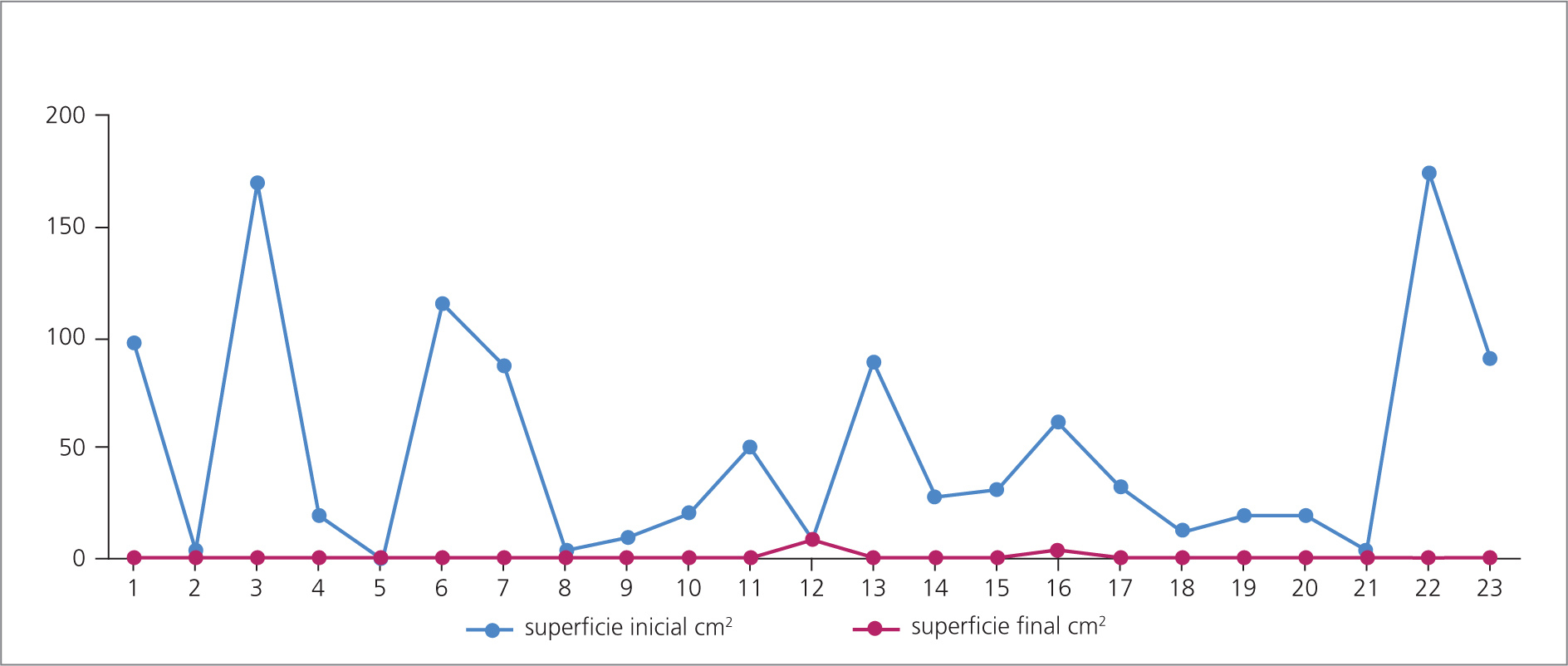
En ocho de los 10 casos del grupo 1, el tamaño de la herida disminuyó hasta el cierre de la misma en el período de seguimiento de tres meses. En los dos casos restantes, la reducción de la superficie de la herida fue de 60% en ese período.
En todos los pacientes del grupo 2 (n=4) se logró controlar el exudado, en promedio, en 15 días. El cierre definitivo de la cavidad ocurrió en 21 días, en promedio.
En el grupo 3, se obtuvo un lecho adecuadamente preparado, sin signos locales de infección ni presencia de signos visuales o indirectos de biofilm, en promedio, en 15 días. Esto permitió una adecuada cobertura quirúrgica con injertos cutáneos, colgajos o matriz dérmica acelular sin complicaciones posteriores a la cobertura quirúrgica.
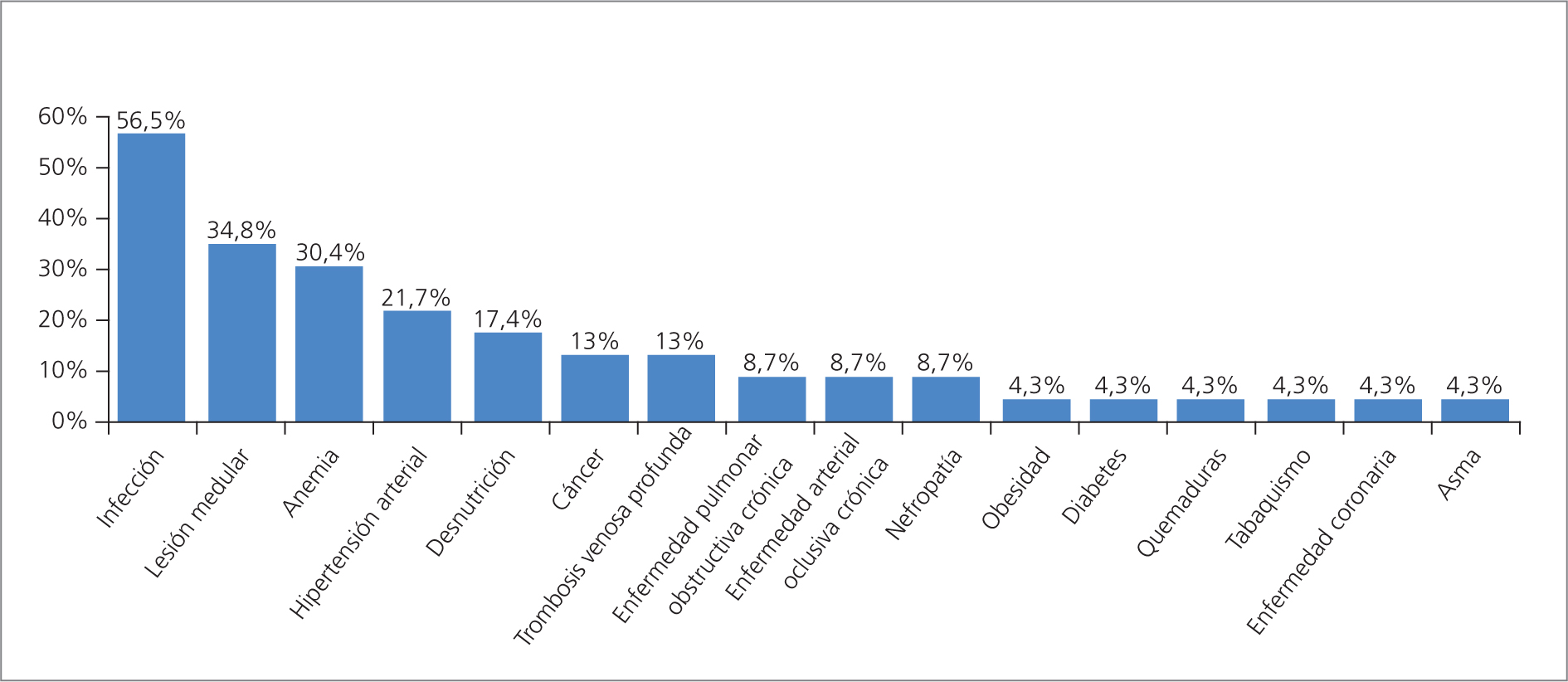
Comorbilidades
Dentro de las comorbilidades encontradas en los pacientes del estudio, la infección estuvo presente en el 56,5% de los casos, seguida por trauma raquimedular (34,8%), anemia secundaria (30,4%) e hipertensión arterial (21,7%) (Fig 2).
Control de signos locales de infección y signos indirectos de biofilm
En todos los casos en que se realizó un seguimiento, se logró un adecuado control de los signos locales de infección (enrojecimiento, calor, edema, dolor y olor). En cuanto a la presencia de dolor, los pacientes dejaron de referirlo incluso con el cambio de cada curación (valor p<0.0001).
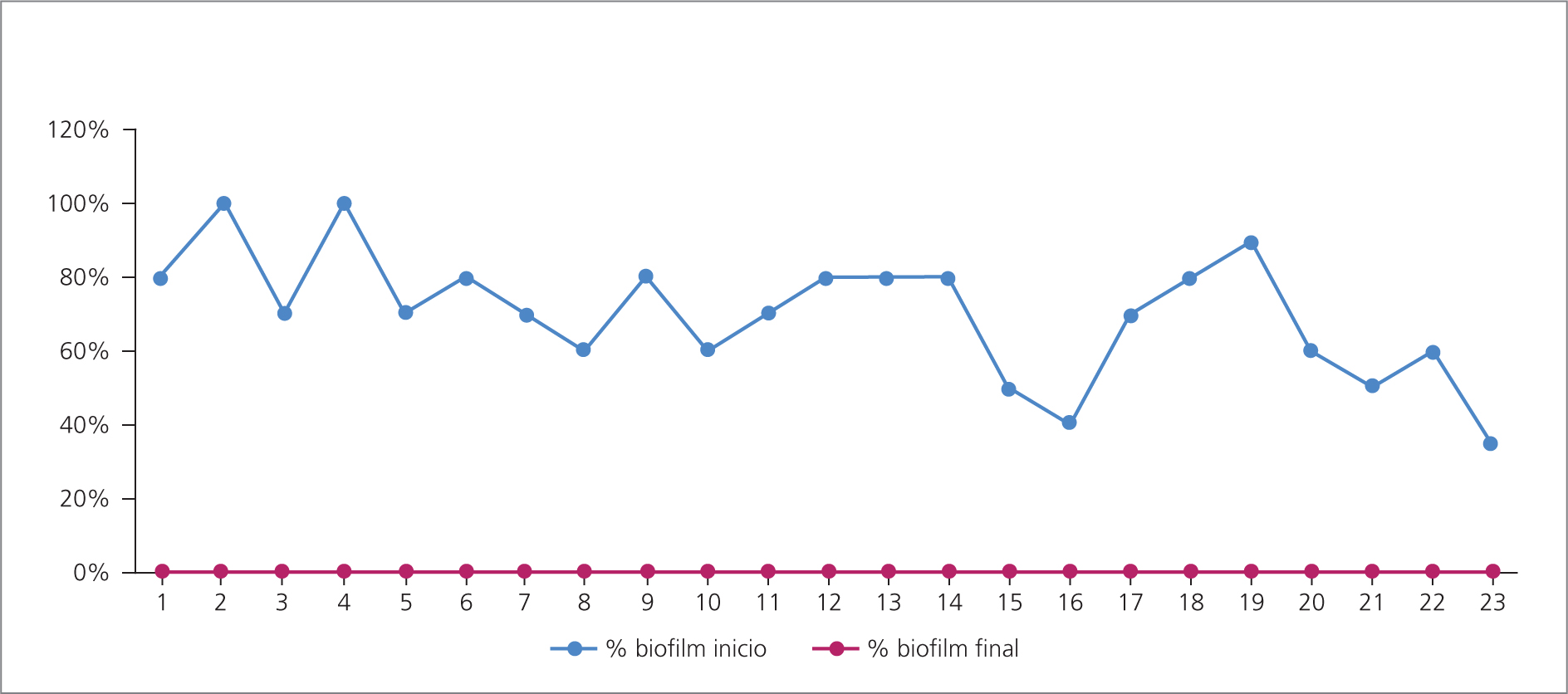
Todas las heridas incluidas en el estudio tenían algún porcentaje de biofilm. Este fue valorado teniendo en cuenta signos visuales e indirectos,36 como humedad excesiva o exudado, poco tejido de granulación o friabilidad del mismo, persistencia de signos locales de infección (a pesar de estar recibiendo tratamiento antimicrobiano), cultivos de secreción negativos (a pesar de tener signos clínicos con alta sospecha de infección), y persistencia de la herida estacionaria (a pesar de tener controladas todas las comorbilidades) (Tabla 3).
| Evaluación inicial n=23 | Evaluación final n=23 | Valor p | |
|---|---|---|---|
| Tamaño Me (RIC) | |||
| Largo (cm) | 11,3 (4,4–17,1) | 0 (0–0) | <0,0001 |
| Ancho (cm) | 3,5 (2,9–5,5) | 0 (0–0) | <0,0001 |
| Profundidad (cm) | 2 (0,5–3,5) | ||
| Superficie (cm) | 23,35 (8,13–86,78) | 0 (0–0) | <0,0001 |
| Síntomas | |||
| Dolor | 16 (69,6%) | 0 (0,0%) | <0,0001 |
| Eritema | 17 (73,9%) | 0 (0,0%) | <0,0001 |
| Edema | 11 (47,8%) | 0 (0,0%) | 0,0005 |
| Calor | 10 (43,5%) | 0 (0,0%) | 0,0013 |
| Mal olor | 17 (73,9%) | 0 (0,0%) | <0,0001 |
| Exudado purulento | 11 (47,8%) | 1 (4,4%) | 0,0026 |
| Biofilm | 15 (65,2%) | 0 (0,0%) | <0,0001 |
| Decoloración del tejido de granulación | 9 (39,1%) | 0 (0,0%) | 0,0030 |
| Tejido de granulación friable | 9 (39,1%) | 1 (4,4%) | 0,0126 |
| Número de síntomas | 5 (3–7) | 0 (0–0) | <0,0001 |
| Lecho de la herida (%) | |||
| Necrótico | 0 (0–30) | 0 (0–0) | 0,0005 |
| Esfacelo | 10 (0–30) | 0 (0–0) | <0,0001 |
| Granulación | 12,5 (0–35) | 0 (0–10) | 0,3928 |
| Epitelización | 0 (0–0) | 100 (0–100) | <0,0001 |
| Biofilm | 60 (32,5–80,0) | 0 (0–0) | <0,0001 |
| Exudado | |||
| Sin exudado | 0 (0,0) | 19 (82,6%) | <0,0001 |
| Bajo | 61 (26,1%) | 4 (17,4%) | 0,7205 |
| Moderado | 5 (21,7%) | 0 (0,0%) | 0,0585 |
| Alto | 12 (52,2%) | 0 (0,0%) | 0,0002 |
| Piel circundante | |||
| Saludable | 3 (13,0%) | 21 (91,3%) | <0,0001 |
| Macerada | 17 (74,0%) | 1 (4,4%) | <0,0001 |
| Seca | 3 (13,0%) | 1 (4,4%) | 0,6098 |
Me: mediana; RIC: rango intercuartil
Al terminar el período de seguimiento de tres meses, en todos los casos hubo ausencia de los signos visuales indirectos de la presencia de biofilm (inicial: mediana RIC 60 [32,5–80,0], final: 0 p<0.001) (Fig 3).
Discusión
Los tres grupos de pacientes obtuvieron un adecuado control de todos los signos locales de infección, de exudado, y la desaparición de los signos visuales e indirectos de biofilm. Todos vieron una adecuada progresión y disminución de la superficie de la herida, mediante el uso de apósitos de hidrofibra reforzada, con iones de plata al 1,2%, y potenciado con EDTA y cloruro de bencetonio. Al considerar los estudios in vitro,40,41,42,43 in vivo16 y clínicos44 que sostienen la efectividad de este apósito y extrapolarlos a nuestros hallazgos, creemos que el apósito es eficaz y seguro para este propósito.
Limitaciones
Hace falta estudios de mayor número de muestra, que utilicen criterios unificados, de asignación aleatoria y multicéntricos, que permitan replicar en mayor magnitud los resultados encontrados en este estudio y favorezcan la medición objetiva de la presencia de biofilm para poder identificar si la acción antibiofilm es determinada por el apósito.
Conclusión
Las heridas de difícil cicatrización son un problema mundial. La evidencia obtenida en este seguimiento de casos (ver casos 1 a 6 a continuación) demuestra que el apósito de hidrofibra reforzada, con plata iónica al 1,2%, potenciado con EDTA y cloruro de bencetonio puede ser efectivo en el control de exudado, infección y signos indirectos de biofilm. Puede, a su vez, ayudar a disminuir el tamaño de la herida, cerrar heridas con absceso y preparar el lecho para una cobertura quirúrgica definitiva. Su uso no presentó eventos adversos, con lo cual, podría decirse que es, también, un apósito seguro.