En heridas complejas o de difícil cicatrización, el tamaño, la profundidad, el estado (ya sea su nivel de exudado, dolor u olor) y las diferentes estructuras de la piel o del tejido subcutáneo pueden dificultar las decisiones de tratamiento, selección y fijación del apósito. Estas decisiones, a su vez, pueden verse afectadas por el conocimiento y las habilidades de los profesionales de la salud a cargo del manejo de la herida. La complejidad de la herida también puede estar relacionada con la situación asistencial del paciente.1
Dichos problemas relacionados con las heridas de difícil cicatrización requieren, a veces, la intervención de un equipo de especialistas y la derivación de pacientes a otros expertos para obtener su opinión o asesoramiento.2 Por eso, un tratamiento estandarizado con protocolos claros podría ofrecer un beneficio adicional al educar a otros profesionales sobre la experiencia existente de una manera coordinada.3
Al analizar el creciente volumen de evidencia científica y clínica con respecto a la biopelícula (biofilm) en heridas, se destacan ciertos mecanismos por los cuales la biopelícula podría retrasar la cicatrización. La biopelícula está asociada con el deterioro del proceso de epitelización y de formación de tejido de granulación, y promueve una respuesta inflamatoria de bajo grado que interfiere con la cicatrización de la herida. Se ha demostrado que las biopelículas polimicrobianas, que existen invariablemente en las heridas de difícil cicatrización, retrasan la curación en mayor medida que las biopelículas de una sola especie.4 Teniendo en cuenta estos efectos, la biopelícula de la herida podría evolucionar como un ecosistema críptico que, en algún momento, estará suficientemente establecido para interferir con la cicatrización de la herida y, de no ser manejada efectivamente, podría generar infección.4
Además de contemplar el desbridamiento (fundamental para eliminar el tejido desvitalizado y deshacerse de la biopelícula para evitar que se vuelva a formar), un protocolo de tratamiento efectivo para heridas de difícil cicatrización debería contemplar todas las necesidades de la herida, y sólo será eficaz si su tratamiento incluye productos antibiopelícula y antimicrobianos que impidan la reformación de la biopelícula.4 Por eso, dicho protocolo debería abarcar cuatro procedimientos fundamentales: limpieza, desbridamiento, cuidado de los bordes de la herida y uso de apósitos antibiopelícula y antimicrobiano efectivos. El concepto de higiene de la herida5 resume estos pasos, y parte de la premisa de que todas las heridas difíciles de cicatrizar contienen biopelícula.
Debido a la velocidad con la que se forma la biopelícula de la herida, una herida que exhibe exudado, desprendimiento y un aumento de tamaño al tercer día de su aparición podría definirse como difícil de cicatrizar.5 Bajo un protocolo de tratamiento completo, los pasos en la higiene de la herida deberían implementarse al mismo tiempo que se abordan las causas subyacentes de la herida y las comorbilidades del paciente. Esto permitirá que la patología de la herida y la biopelícula se manejen simultáneamente.
Ciertos algoritmos de identificación clínica de biopelícula6 podrían apoyar el seguimiento de la evolución de las heridas complejas y facilitar la elección del apósito apropiado.
Materiales y métodos
El objetivo de este estudio fue presentar un protocolo para evitar la recurrencia de biopelícula en heridas de difícil cicatrización con el uso de un apósito de hidrofibra reforzada, con plata iónica al 1,2%, potenciado con ácido etilendiaminotetraacético (EDTA) y cloruro de bencetonio, aplicando el algoritmo de identificación clínica de biopelícula y el concepto de higiene de la herida5 en una serie de casos de estudio.
Se realizó un estudio retrospectivo, descriptivo y analítico de tres casos de estudio de pacientes con heridas de difícil cicatrización tratados en el Centro de Tratamiento de Úlceras y Enfermedades Venosas (CTDV, por sus siglas en portugués) en Salvador, Bahía, Brasil. El centro es una unidad ambulatoria que atiende pacientes remitidos desde el departamento de salud municipal para diagnóstico y tratamiento en las áreas de angiología y cirugía vascular. Cuenta con un equipo de enfermeros, técnicos de enfermería, especialistas en angiología y cirugía vascular, psicólogos, fisioterapeutas y nutricionistas.
El presente estudio se realizó en conformidad con la Resolución CNS No. 466 de 2012, del Consejo Nacional de Salud7 y sus suplementos (Resolución No. 510 de 2016).8 Los participantes firmaron un formulario de consentimiento libre e informado, y autorizaron el uso de imágenes.
Los registros de pacientes con úlceras de difícil cicatrización se analizaron de acuerdo con el algoritmo de identificación de signos clínicos de sugerencia para la presencia de biopelícula,6 y según la aplicación de las recomendaciones para la higiene de heridas.5 Los datos analizados fueron: fecha de la primera evaluación de la herida de difícil cicatrización, duración de la herida abierta, sexo y edad del paciente, antecedentes familiares, otras enfermedades asociadas, y dolor. El seguimiento y los resultados observados fueron descriptos en cada caso.
Todas las curaciones fueron realizadas en el centro de referencia. El proceso de curación consistió en la aplicación de un apósito de hidrofibra reforzada, con iones de plata al 1,2%, potenciado con EDTA y cloruro de bencetonio (Aquacel Ag+ Extra, ConvaTec Inc.), como apósito primario, y cubrimiento de manera oclusiva con apósito secundario o terapia de compresión asociada. Las curaciones se realizaron según el tamaño de la herida, su respuesta clínica, y el grado de saturación del apósito primario. Este procedimiento se repitió en los tres casos de estudio, hasta alcanzar la cicatrización.
Una herida compleja o de difícil cicatrización es una herida que no ha respondido al estándar de atención basado en evidencia, ni ha evolucionado naturalmente en su tercer día de tratamiento.5 Para determinar la posible presencia de biopelícula, se aplicó el algoritmo de identificación clínica de biopelícula y se utilizaron las siguientes variables dicotómicas (sí o no):
Los primeros tres puntos son clasificados como indicadores visuales de identificación clínica de biopelícula, mientras que los otros tres son considerados indicadores indirectos.6 Por eso, en nuestro estudio, fueron consideradas clínicamente heridas con biopelícula aquellas que tuvieran “sí” para los indicadores visuales y “sí” para todos los indicadores indirectos (Cuadro 1).
Para evaluar la efectividad de la higiene en las heridas, se estudiaron los cuatro pasos del concepto de higiene de las heridas5 con las siguientes variables dicotómicas (Cuadro 2):
Las heridas con higiene efectiva presentaron “sí” en todas las etapas.
Resultados
El protocolo adoptado en el CTDV de Salvador se basó en tres pilares:

A continuación, los autores desarrollan los resultados obtenidos a partir de tres casos de estudio.
Caso 1
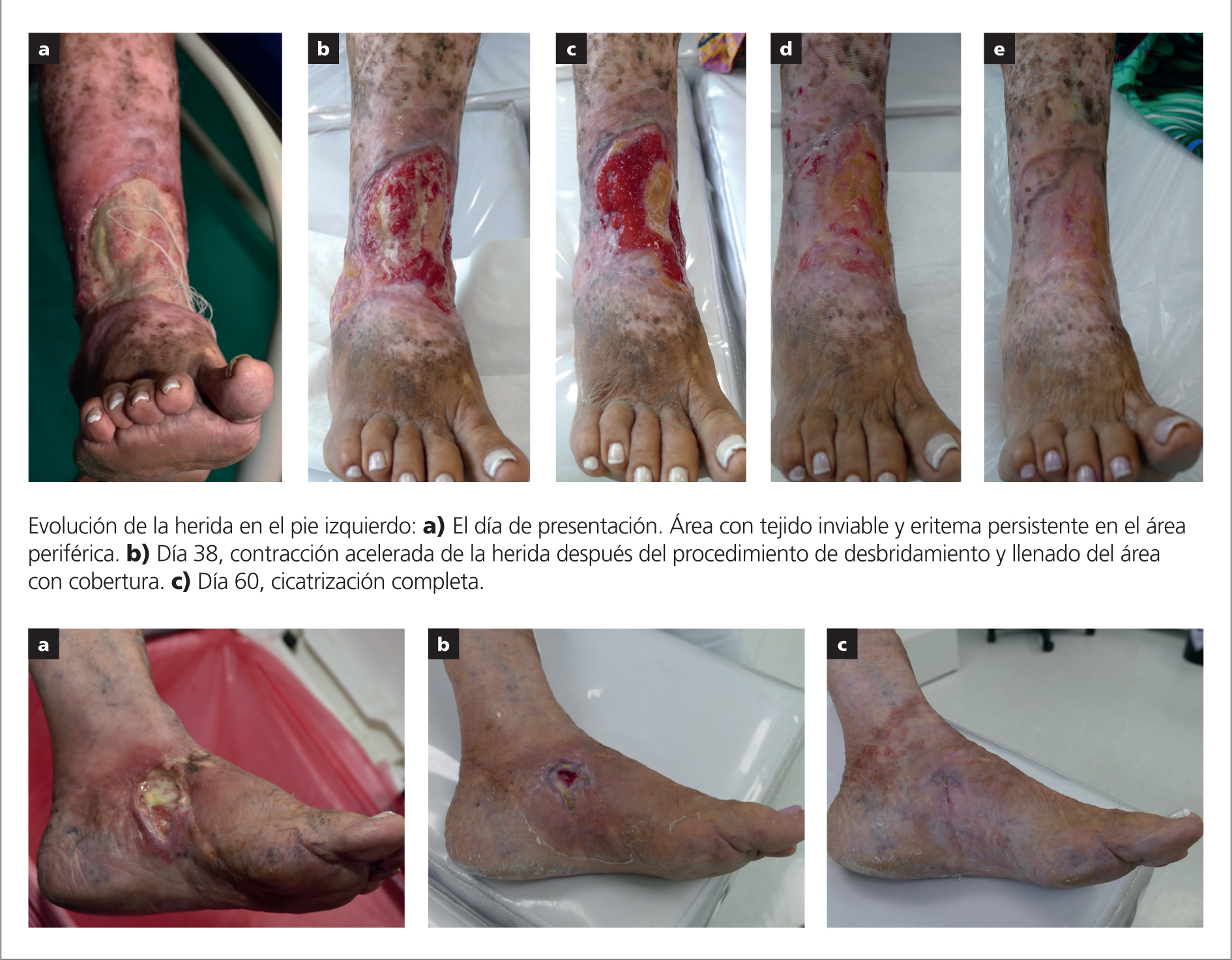
El primer caso describe una mujer de 69 años, multípara, que se presentó con insuficiencia venosa crónica, reflujo bilateral de la vena safena magna, venas varicosas, y una úlcera venosa bilateral en la pierna derecha y el pie izquierdo. Su historial médico incluía fiebre sistémica, hipertensión, depresión asociada con insomnio, y dolor severo (8 en la escala analógica visual para el dolor, que abarca del 0–10). Había sido previamente diagnosticada con esofagitis, gastritis y uso crónico de medicamentos antiinflamatorios no esteroideos para el dolor. Su índice de masa corporal (IMC) era 17,9 kg/m2.
La paciente presentaba una úlcera en la pierna derecha y en la región medial del pie izquierdo, ambas sin cicatrización. El lecho de la herida estaba infectado y con altos niveles de exudado. Había, también, señales de debilitamiento del borde de la herida, eritema y dolor. La herida de la pierna derecha medía 15cm (largo), con una profundidad de 1cm y un ancho de aproximadamente 22cm, que ocupaba casi toda la circunferencia del tercio distal de la pierna derecha. La herida de la pierna izquierda medía 5cm (largo) y 3,5cm (ancho), con una profundidad de 1,5cm.
El régimen de tratamiento incluyó apoyo psicológico, control de la hipertensión, visita y orientación nutricional, y antibióticos orales (ciprofloxacina de 500mg, dos veces por día) durante 14 días, ya que una biopsia de la pierna derecha demostró la presencia de Pseudomonas aeruginosa. Se realizó un desbridamiento agudo del lecho de las heridas y se aplicó terapia de compresión inelástica (Flexi-Dress, ConvaTec, Inc.), junto con el apósito de hidrofibra reforzada. Además, se realizó escleroterapia con espuma guiada por ultrasonido para tratar tanto la vena safena magna como los afluentes durante la tercera semana de tratamiento después de la infección.
La paciente respondió bien al tratamiento local y sistémico. Después de 20 días de tratamiento, el puntaje de dolor cayó de 8 a 2 y, luego, a 0. El apósito de hidrofibra reforzada funcionó bien bajo terapia de compresión. Las heridas cicatrizaron completamente a los 150 (pierna derecha) y 60 días (pie izquierdo).
Caso 2
El segundo caso describe un hombre de 82 años, fumador (10 cigarrillos por día), con una úlcera de pie diabético. Tenía antecedentes de diabetes mellitus tipo 2 no regulada en los últimos cinco años, y neuropatía periférica en los últimos dos años. La evaluación de la enfermedad arterial periférica encontró estenosis y oclusiones de las tres arterias debajo de la rodilla, sin calcificación severa. El índice tobillo-brazo fue de 0,68. En la primera semana de tratamiento (creatinina 1,7 mg/dL y urea 48 mg/dL) se le diagnosticó insuficiencia renal crónica. Su IMC era 22,6 kg/m2.
El paciente tenía una herida dorsal y en el maléolo, y presentaba disestesia y sensaciones de frío y calor. La herida medía 17cm (largo) y 7,8cm (ancho), con una profundidad de 1,2cm en el borde inferior. Presentaba infección superficial y profunda, pero una radiografía descartó osteomielitis.
Se realizó desbridamiento y se trató la infección, además del manejo del exudado y equilibrio húmedo, y control del edema perilesional por compresión inelástica de baja presión (Flexi-Dress). El paciente recibió el apósito de hidrofibra reforzada el día 0 del tratamiento. El régimen de tratamiento incluyó un primer cambio de apósito el día 3 (debido a la infección inicial), día 5 y, finalmente, semanal. Se apuntó a corregir sus niveles de glucosa. Se le dieron instrucciones para descargar, dejar de fumar, y tomar antibióticos (ciprofloxacina y clindamicina). Se proporcionó calzado cómodo para la curación y prevención.
El seguimiento del protocolo de tratamiento, junto con el apósito de hidrofibra reforzada, demostraron buenos resultados en el proceso de curación. Se alcanzó la cicatrización completa el día 102.
Caso 3
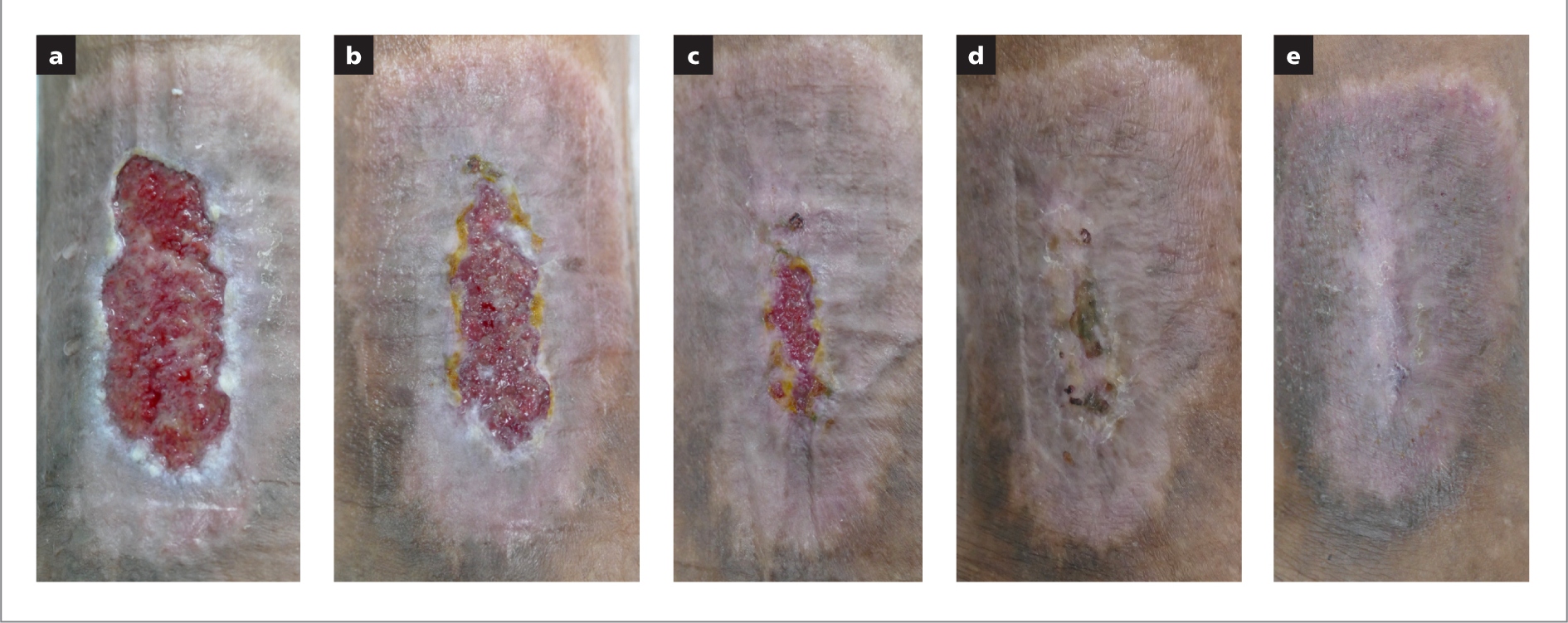
El tercer caso describe una mujer de 38 años, con insuficiencia venosa crónica y una úlcera venosa recurrente en su pierna izquierda. La paciente es ama de llaves y trabaja unas 8 horas de pie por día, sin descansos. La recurrencia de su úlcera ocurrió durante su último embarazo, un año antes de ser admitida en el centro donde los autores trabajan. Su historia clínica incluye hipertensión y síndrome postrombótico en su miembro izquierdo inferior, después de una trombosis venosa profunda nueve años atrás. Presenta, también, sobrepeso (IMC: 28,8 kg/m2).
El proceso de curación de su herida fue difícil, debido al alto nivel de dolor que la paciente sufría durante el desbridamiento y los cambios de apósito, y a que tenía que continuar trabajando de pie y amamantando a su bebé durante la implementación del protocolo. El primer cambio de apósito fue el día 3, debido a los altos niveles de exudado. El régimen de tratamiento se enfocó en controlar la hipertensión, ofrecer orientación nutricional para la pérdida de peso, y tratar la ansiedad. Se realizó desbridamiento agudo del lecho de la herida, pero los altos niveles de dolor dificultaron este proceso. Los autores decidieron aplicar terapia de presión negativa (Avelle, ConvaTec, Inc.), que ya cuenta con un apósito de hidrofibra en su composición. La terapia puede ser utilizada por 30 días con el mismo equipamiento para acelerar el manejo de heridas de difícil cicatrización.
Después de 14 días de tratamiento, el puntaje de dolor bajó de 9 a 3 en la escala analógica visual y, luego, a 0. La herida cicatrizó completamente el día 55. La estrategia de asociación de tecnologías (terapia de compresión y de presión negativa) permitió acelerar el proceso de curación, y fue central en la evolución de este caso.
Discusión
Los tres casos de estudio presentan diferentes tipos de úlceras vasculogénicas con mecanismos etiopatogénicos distintos. El factor común son los largos períodos de tratamiento previo sin éxito antes de llegar al centro de referencia.
Los tres pacientes obtuvieron un adecuado control de todos los signos locales de infección, de exceso de exudado, y la desaparición de los signos visuales e indirectos de biopelícula. Todos vieron una adecuada progresión y disminución de la superficie de la herida y cicatrización, mediante el uso del apósito de hidrofibra reforzada, con iones de plata al 1,2%, y potenciado con EDTA y cloruro de bencetonio, dentro de un protocolo completo de manejo integral del paciente.
En concordancia con el protocolo utilizado en el centro de referencia, para las úlceras venosas y de pie diabético, a menudo se requiere un enfoque multidisciplinario. Sin embargo, la atención médica, de enfermería capacitada y otros servicios involucrados dependerán de la disponibilidad local, la complejidad de la herida, y las necesidades del paciente. Se debe realizar una evaluación integral para determinar el historial médico pasado, la movilidad actual, los niveles de dolor y la nutrición, los entornos domésticos y laborales, la participación del cuidador o familiar a cargo del paciente, y las inquietudes del paciente (por ejemplo, sensación de pesadez y opresión en las piernas, hinchazón, molestias y dolor).9
Un estudio10 hace referencia al consenso general de que la biopelícula puede contribuir al retraso de la curación y que, por lo tanto, debe manejarse. Este estudio también destaca la necesidad de nuevas y más efectivas tecnologías antibiopelícula y estrategias de manejo de heridas para ayudar a sanar las heridas más rápidamente y beneficiar a los pacientes, cuidadores y sistemas de salud.10 Si bien hay un conocimiento general sobre la biopelícula, su manejo aún no es lo suficientemente claro. Al considerar los estudios in vitro,11,12,13,14,15 in vivo16 y clínicos,17,18 que sostienen la efectividad del apósito de hidrofibra reforzada, y extrapolarlos a nuestros hallazgos, creemos que el apósito fue eficaz y seguro en el manejo de la biopelícula. El apósito, que agrega Hydrofiber Technology (ConvaTec, Inc.), es un antimicrobiano de última generación19 que combina componentes antibiopelícula y antimicrobianos. Estos funcionan en sinergia para interrumpir la biopelícula y exponer los microorganismos asociados a la acción antimicrobiana de amplio espectro de la plata iónica. El apósito puede beneficiar el manejo de las heridas e infecciones con biopelícula y promover la cicatrización.13 Es evidente la diferencia de rendimiento entre los apósitos con tecnología combinada de antibiopelícula y antimicrobiano frente a aquellos con propiedades antimicrobianas solas.15 Además, seleccionar un agente antimicrobiano tópico efectivo puede ser un desafío para los profesionales de la salud cuando los datos utilizados para respaldar las afirmaciones antimicrobianas sólo se basan en estudios in vitro que involucran bacterias planctónicas de una sola especie.
Estudios previos ya han demostrado su eficacia en diferentes tipos de casos de heridas que requieren el manejo de la biopelícula y evitan su reformación, así como el control del exudado y la alta carga microbiana de manera rápida y sostenible. Puede, a su vez, ayudar a disminuir el tamaño de la herida, cerrar heridas con absceso y preparar el lecho para una cobertura quirúrgica definitiva. Su uso no presentó eventos adversos, con lo cual, podría decirse que es, también, un apósito seguro.20
Otro punto de discusión es la identificación clínica de la biopelícula. A través de una revisión de la literatura y una comprensión actual de la biopelícula de la herida, ha sido posible recopilar una variedad de indicadores visuales que podrían indicar directamente la presencia de la biopelícula, junto con otros indicadores clínicos indirectos, que han permitido colectivamente el desarrollo de un algoritmo clínico para la presencia de biopelícula en la herida. Por eso, es importante que la evaluación considere los signos que pueden orientar la práctica y ser parte de un protocolo de rutina, ya que el reconocimiento de la existencia de biopelícula en heridas de difícil cicatrización está aumentando entre los profesionales del cuidado de heridas, y un creciente conjunto de evidencia indica que la biopelícula contribuye significativamente al retraso de la cicatrización de heridas.6
En algunas heridas de difícil cicatrización, la formación de la biopelícula puede progresar a una etapa donde es macroscópica y visible a simple vista. Por ejemplo, una sustancia brillante y translúcida en la superficie de la herida podría indicar una biopelícula delgada pero observable, cuyo desbridamiento puede revelar un lecho de herida más saludable.21 Sin embargo, esta sustancia coloreada puede ser difícil de distinguir visiblemente del esfácelo (slough). Si bien puede parecerse al tejido desvitalizado, se comporta de manera diferente ya que puede eliminarse más fácilmente, pero se forma rápidamente, lo cual es un signo indicativo clave de la biopelícula de la herida.6
En muchos casos donde la biopelícula de la herida no es claramente distinguible a simple vista, otros signos clínicos pueden indicar su presencia: humedad excesiva; tejido de granulación de baja calidad, por ejemplo, friable; signos locales de infección; antecedentes de uso ineficaz de antibióticos; y que la herida permanezca sin cicatrización a pesar de haber sido tratada.22
La unión entre la identificación clínica de la biopelícula y las prácticas de higiene de la herida son fundamentales. La higiene de la herida debe implementarse al mismo tiempo que se abordan las causas subyacentes de la herida y las comorbilidades del paciente. Esto asegurará que la patología de la herida y la biopelícula se manejen simultáneamente.5
Un punto importante y que puede generar una diferencia considerable en el manejo de estas heridas son los bordes y la remodelación efectiva. Se ha observado biopelícula en los bordes de las heridas. La carga biológica dentro de la piel perilesional, particularmente en el tejido desvitalizado, afecta la carga biológica en la herida y, por lo tanto, su borde. La evidencia ha identificado consistentemente un mayor número de células bacterianas en muestras de tejido de la herida desde los bordes de la herida que desde el centro.23 Por eso, el principio básico adoptado en este protocolo es el de la higiene de la herida (es decir, eliminar o minimizar todos los materiales no deseados, incluida la biopelícula, el tejido desvitalizado y los desechos extraños de la herida), abordar cualquier biopelícula residual, y evitar su reformación. Finalmente, al interrumpir y eliminar la biopelícula, y al prevenir su reformación, se espera que la higiene de la herida reduzca el riesgo de infección. Esto podría, a su vez, reducir el uso de antibióticos en el cuidado de heridas5 y otros costos relacionados con una herida difícil de cicatrizar.
Los niveles de conocimiento y las experiencias en cuanto al manejo de biopelícula en heridas de difícil cicatrización varían de un país a otro. Por eso, estandarizar prácticas con protocolos para heridas difíciles de tratar, especialmente en casos de pies diabéticos y úlceras venosas, puede beneficiar la resolución de los casos y la optimización de recursos humanos y financieros. Cuando replicar prácticas simples, sin importar el nivel de experiencia del profesional de la salud, se vuelve posible, entonces más profesionales pueden manejar heridas de difícil cicatrización con mejor criterio y mayor confianza.
Limitaciones
Es necesario realizar estudios con criterios unificados, de asignación aleatoria y multicéntricos que permitan calificar con mayor detalle y alcance la efectividad de este protocolo.
Conclusión
Considerar la biopelícula presente en heridas de difícil cicatrización como una causa independiente de retraso de la cicatrización, así como elegir un apósito efectivo para impedir la reformación de la biopelícula, es clave dentro de un protocolo integral de atención.
La capacidad de cicatrización de heridas bajo este protocolo con apósito de hidrofibra reforzada, con plata iónica al 1,2%, potenciado con EDTA y cloruro de bencetonio puede considerarse alta si se siguen las prácticas de higiene de la herida recomendadas.5 Todos los pacientes lograron la cicatrización de manera oportuna y el control de los factores locales que impedían la cicatrización. El protocolo adoptado permitió un enfoque holístico para el tratamiento de pacientes con heridas de difícil cicatrización.
Establecer protocolos efectivos para el tratamiento de pacientes con heridas de difícil cicatrización podría aliviar un problema grave de salud pública con altos costos socioeconómicos y brindar una mejor calidad de vida a esta población.
