Las úlceras de pie diabético (UPD) son una de las complicaciones más costosas y devastadoras de la diabetes. Los pacientes con UPD suelen presentar neuropatía y/o enfermedad arterial periférica del miembro inferior, que complican el proceso de curación.1 Las UPD se encuentran en un 4–10% de la población diabética estadounidense.2–4
Lograr un tratamiento eficaz es fundamental, ya que la amputación de las extremidades inferiores es entre 15 y 46 veces más probable en pacientes diabéticos.5,6
Es deseable que los profesionales de la salud utilicen mediciones objetivas para seleccionar, evaluar y modificar el tratamiento de UPD. Es necesario, también, evaluar cuidadosamente la eficacia de los protocolos de tratamiento utilizados, y buscar señales tempranas de mejora en los marcadores objetivos medibles.
Los déficits circulatorios y la falta de perfusión alrededor de la herida retrasan la cicatrización en el paciente diabético. Se deben considerar los dispositivos de imágenes avanzados para evaluar los problemas subyacentes.7 Los escáneres de infrarrojo cercano (NIRS, por sus siglas en inglés) son una herramienta valiosa para evaluar las áreas de mala perfusión dentro y alrededor de las heridas, y predecir su probabilidad de curación.8,9 Las imágenes NIRS, o de espectroscopia de infrarrojo cercano, se utilizan para medir la saturación de oxígeno tisular (StO2) en las úlceras de las piernas antes y durante el curso del tratamiento. El oxígeno es un factor crucial en la curación de heridas, y es necesario para regenerar el tejido afectado.10,11 El análisis cuidadoso de estos parámetros objetivos es particularmente importante en el paciente diabético con heridas, debido a su alto riesgo de amputación y potencial mortalidad.5
La cicatrización normal de heridas pasa por cuatro fases principales: hemostasia, inflamación, reparación y remodelación. Las heridas de difícil cicatrización suelen quedar estancadas en la etapa inflamatoria12 y requerir la intervención de protocolos de cuidado de heridas avanzados para progresar a la cicatrización. Las matrices dérmicas acelulares son injertos de tejido conectivo blando, fabricados mediante un proceso de descelularización que preserva la matriz cutánea extracelular intacta.13 Está documentado que la matriz extracelular (MEC) juega un papel importante en la progresión de la curación de UPD y otras heridas de difícil cicatrización.14 Los componentes de la MEC son cruciales en todo el proceso de cicatrización, ya que permiten la adhesión celular, quimiotaxis y migración de células.15
Un estudio reciente concluyó que el uso de una nueva matriz de coágulo de sangre completa (WBC, por sus siglas en inglés) autóloga es segura y eficaz en el tratamiento de UPD.16,17 El WBC sirve como una capa protectora, que mantiene un ambiente húmedo debajo de la herida, y permite que se lleve a cabo la remodelación del tejido.16,17
Este estudio evaluó la respuesta inmune de una matriz de WBC autóloga en UPD, aplicada en intervalos de una semana. El objetivo secundario fue medir la respuesta de cicatrización de la herida, basada en la mejora de la perfusión de oxígeno, la reepitelización, y la reducción porcentual del área (PAR, por sus siglas en inglés).
Métodos y materiales
Este estudio prospectivo y de etiqueta abierta se realizó en pacientes tratados por UPD en una clínica privada de atención ambulatoria de heridas en San Juan, Puerto Rico, entre enero y marzo de 2020. Se utilizó una matriz de WBC autóloga, creada con el sistema RD1 (RedDress Ltd, Pardes-Hanna, Israel). Este sistema se utiliza en el punto de atención para preparar un gel de WBC, a partir de una pequeña muestra de la propia sangre periférica del paciente, que se aplica tópicamente para tratar heridas cutáneas exudativas, como úlceras en las extremidades.
Todos los pacientes presentaron su consentimiento informado por escrito para participar del estudio. Fueron incluidos aquellos pacientes que, al presentarse en la clínica, tuvieran una UPD durante, al menos, cuatro semanas sin cicatrizar. Se excluyeron los pacientes con UPD de más de nueve meses.
Los pacientes con heridas de difícil cicatrización fueron tratados con WBC. La sangre de cada paciente se extrajo con una jeringa, se mezcló con una suspensión coloidal de gluconato de calcio/caolín, y se inyectó en una bandeja de coagulación. Luego de 10 minutos, se formó un coágulo, se colocó sobre la herida, y se fijó con apósitos primarios y secundarios (de espuma simple y gasa).18 El producto del coágulo de sangre sirve como una MEC funcional y natural para el proceso de curación de heridas.17
Se utilizó el dispositivo Snapshot NIRS (Kent Imaging, Calgary, Canadá) para medir la StO2, hemoglobina (Hb), oxihemoglobina (HbO2), y hemoglobina total (tHb) del tejido en la base de la herida y el área periulceral. Se usó el medidor de pH dérmico de heridas NAWA TR26 (NAWA Technology Ltd., Núrenberg, Alemania) para medir el pH y la temperatura de la base de la herida (Figura 1).

Tres pacientes con UPD de difícil cicatrización fueron tratados con entre dos y cuatro aplicaciones, una vez cada siete días. Se tomaron medidas con el dispositivo NIRS y el medidor de pH dérmico, antes y durante el tratamiento.
Resultados
Tras la aplicación de la matriz autóloga, los tres pacientes con UPD de difícil cicatrización presentaron una reducción en el tamaño de sus heridas y un aumento en la StO2. Los siguientes casos de estudio resumen los resultados obtenidos.
Caso 1
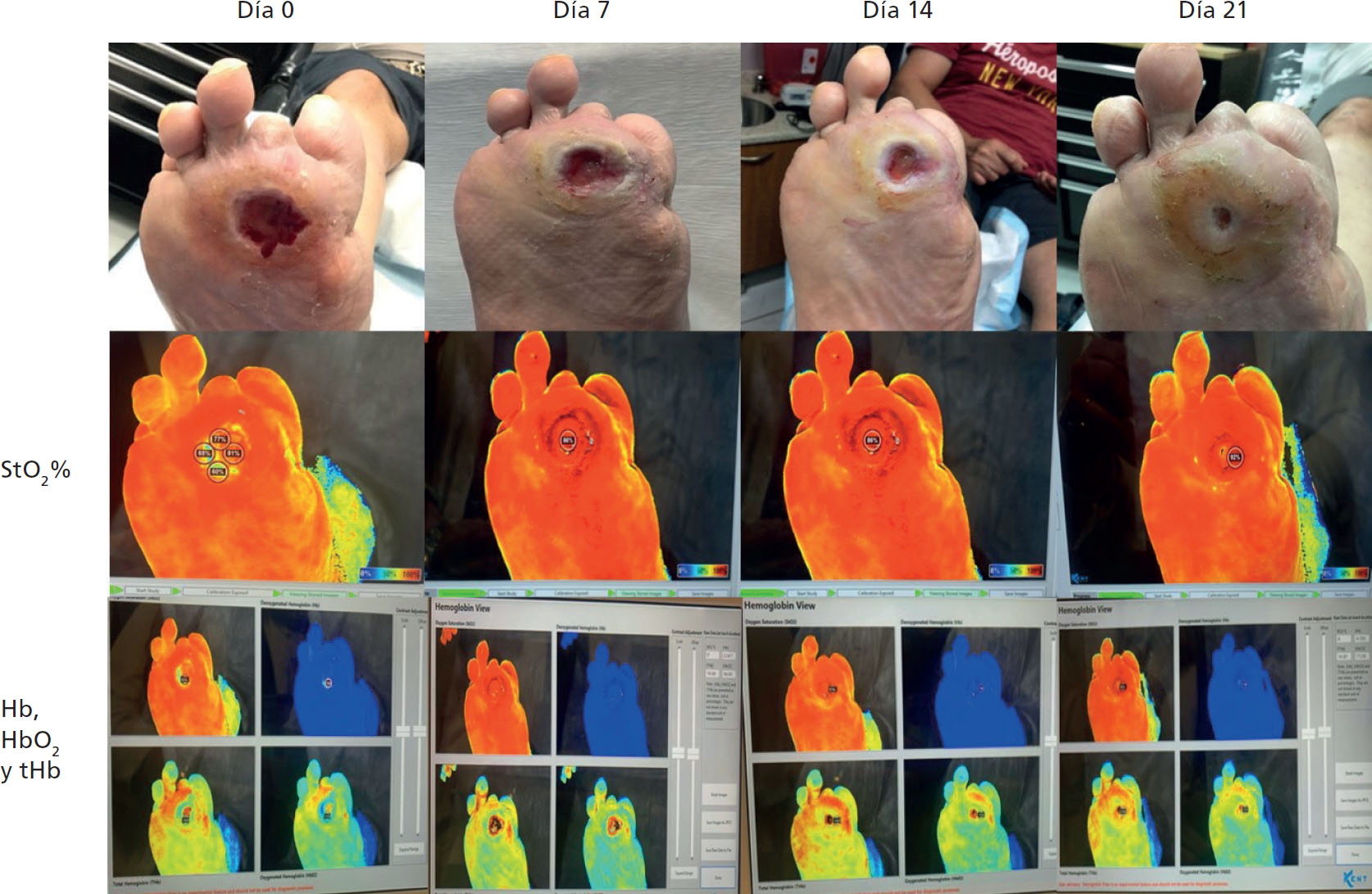
El primer caso describe un hombre de 58 años con una UPD de 18 meses de evolución (grado 3, en la clasificación de Wagner), localizada en las cabezas del primer, segundo y tercer metatarsiano del pie derecho. El paciente presentó las siguientes comorbilidades: diabetes mellitus tipo 2, neuropatía, atrofia de la grasa metatarsiana, y amputación previa de la segunda falange del pie derecho.
En el comienzo del tratamiento con el sistema de WBC, la herida presentó una StO2 de 66%, y el tejido regional mostró buena perfusión sin signos de isquemia.
Después del primer tratamiento con el sistema de WBC, se tomó una nueva medida de StO2 que arrojó 87%, es decir, un aumento de 32%, lo que indicó un alza en la angiogénesis y la perfusión tisular. La StO2 en la herida ascendió a 92% después de tres aplicaciones de la matriz autóloga. La tHb, a su vez, aumentó 13,7% después de tres semanas. Luego de tres aplicaciones y 21 días, la herida estaba casi cicatrizada (Figura 2 y Cuadro 1).
| Día | Solicitud # | pH | StO2 | Hb | tHb | HbO2 |
|---|---|---|---|---|---|---|
| 0 | 1 | 7 | 66% | 54,39 | 168,9 | 114,55 |
| 7 | 2 | 7,4 | 87% | 23,54 | 190,1 | 166,54 |
| 14 | 3 | 7,3 | 91% | 14,04 | 166,4 | 152,4 |
| 21 | Evaluación | 7,9 | 92% | 14,7 | 192,1 | 177,3 |
StO2: saturación de oxígeno tisular. Hb: hemoglobina. HbO2: oxihemoglobina. tHb: hemoglobina total
Antes de la primera aplicación de la matriz autóloga, la herida midió 3cm x 3,5cm x 0,5cm, con una superficie de 10,5cm2. Pasados los 21 días, la herida se contrajo a 0,5cm x 0,5cm x 0,3cm, y una superficie de 0,25 cm2. Es decir, una reducción en tamaño de 97,6% después de tres aplicaciones en 21 días.
Además del tratamiento con la matriz autóloga, el paciente recibió descarga simple y elevación de la extremidad inferior.
Caso 2
El segundo caso describe una mujer de 68 años con una UPD de un mes de evolución (grado 2, en la clasificación de Wagner), localizada en la cara lateral del quinto metatarsiano del pie derecho. La paciente presentó diabetes mellitus tipo 2 e insuficiencia arterial.
En el inicio del tratamiento con el sistema de WBC, la herida arrojó una StO2 de 77% y el tejido regional mostró mala perfusión, como lo indican las áreas en color amarillo del pie del paciente (Figura 3). Después del primer tratamiento con el sistema de WBC, se tomó una nueva medida de StO2 que presentó 81%, es decir, un aumento de 5%. La StO2 en la herida ascendió a 83% después de dos aplicaciones de la matriz autóloga, lo que representó un aumento de 7,8% en 14 días. La tHb, a su vez, aumentó 21,6% en ese período (Cuadro 2).

| Día | Solicitud # | pH | StO2 | Hb | tHb | HbO2 |
|---|---|---|---|---|---|---|
| 0 | 1 | 8,9 | 77% | 39,3 | 171,4 | 132,7 |
| 7 | 2 | 7,9 | 81% | 29,8 | 165,8 | 136 |
| 14 | Evaluación | 7,6 | 83% | 35,8 | 208,4 | 172,5 |
StO2: saturación de oxígeno tisular. Hb: hemoglobina. HbO2: oxihemoglobina. tHb: hemoglobina total
Previo a la primera aplicación de la matriz autóloga, la herida midió 3cm x 2,5cm x 0,3cm, con una superficie de 7,5cm2. Después de 12 días, la herida redujo su tamaño a 1,5cm x 1,5cm x 0,3cm, y una superficie de 2,25cm2. Es decir, una contracción de 70% después de dos aplicaciones en 14 días.
El paciente también recibió descarga simple y elevación de la extremidad inferior.
Caso 3
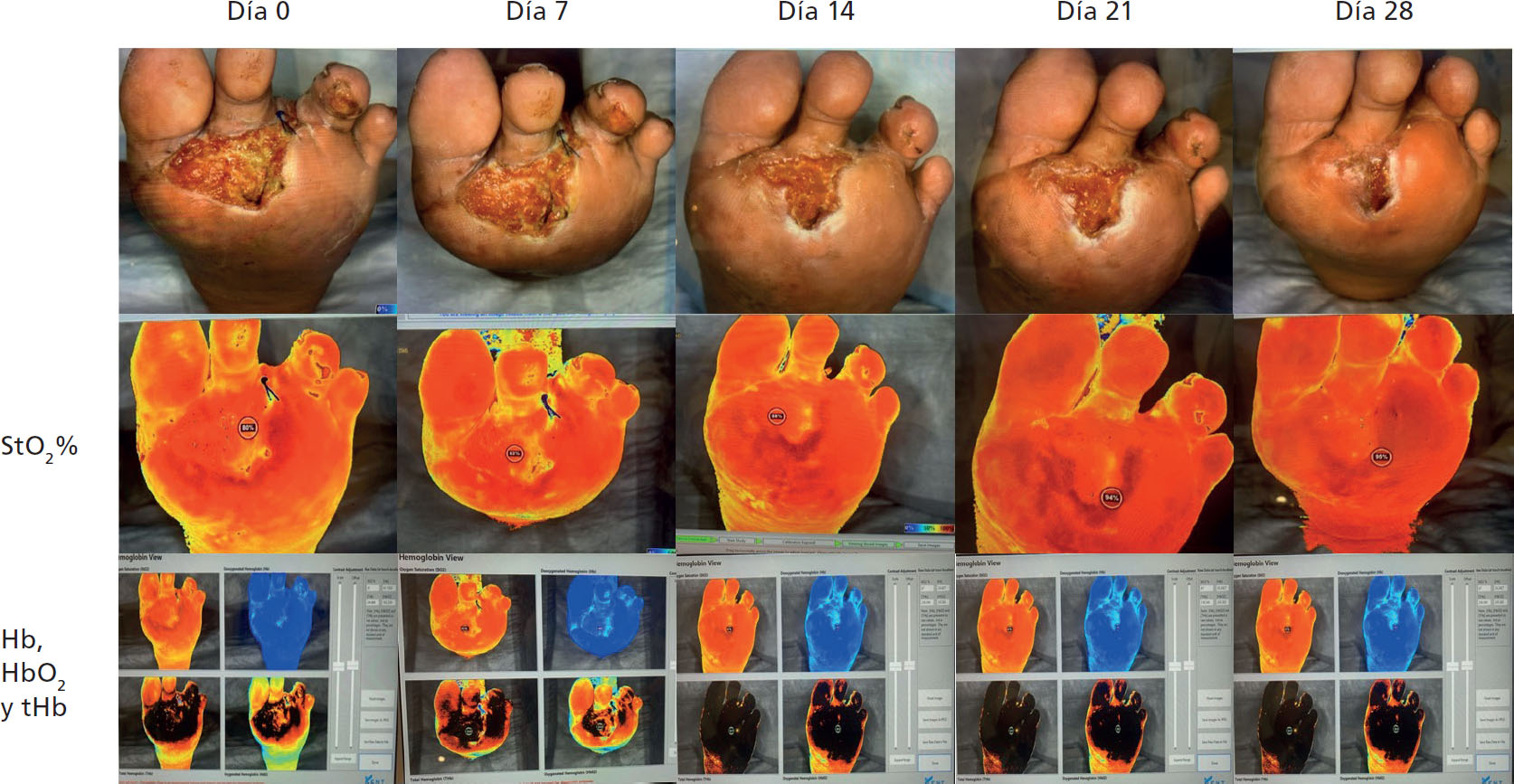
El tercer caso describe un hombre de 58 años con una UPD de un mes de evolución (grado 3, en la clasificación de Wagner), localizada sobre la amputación de la tercera falange del pie izquierdo, extendida sobre la zona del segundo metatarsiano. El paciente presentó las siguientes comorbilidades: diabetes mellitus tipo 2 no controlada, polineuropatía, y amputación de la falange del pie izquierdo con gangrena.
En el comienzo del tratamiento con el sistema de WBC, la herida presentó una StO2 de 80% y el tejido regional mostró buena perfusión, como lo indica el área en color rojo que rodea el lecho de la herida (Figura 4). La StO2 en la herida aumentó a 95% después de cuatro aplicaciones de la matriz autóloga, es decir, un incremento de 19%. El día 28, estaba casi cicatrizada. En ese período, la tHb aumentó 21,5% (Cuadro 3).
| Día | Solicitud # | pH | StO2 | Hb | tHb | HbO2 |
|---|---|---|---|---|---|---|
| 0 | 1 | 8,2 | 80% | 41,1 | 204,4 | 163,3 |
| 7 | 2 | 7,4 | 83% | 39,8 | 243,8 | 203,9 |
| 14 | 3 | 7,6 | 87% | 33,2 | 236,5 | 203,3 |
| 21 | 4 | 7,8 | 94% | 11,7 | 207,8 | 196 |
| 28 | Evaluación | 8 | 95% | 13,3 | 248,3 | 235 |
StO2: saturación de oxígeno tisular, Hb: hemoglobina. HbO2: oxihemoglobina. tHb: hemoglobina total
Antes de la primera aplicación de la matriz autóloga, la herida midió 3cm x 5,5cm x 0,5cm, con una superficie de 16,5 cm2. Después de 12 días, la herida se contrajo a 1,5cm x 1cm x 0,3cm, y una superficie de 1,5cm2. Esto significó una reducción de 90,9% del tamaño de la herida después de cuatro aplicaciones en 28 días.
Además del tratamiento con la matriz autóloga, el paciente recibió descarga simple y elevación de la extremidad inferior.
Discusión
La matriz de WBC autóloga fue eficaz en la curación de las tres UPD. El procedimiento y la aplicación de la matriz fueron sencillos, y no se observaron reacciones adversas.
Las mediciones de StO2 tomadas en la visita inicial para cada herida habían sido valores bajos, que indicaron una disminución del suministro de oxígeno y/o una mayor extracción de oxígeno de Hb, debido a un estado hipermetabólico. Sin embargo, las imágenes NIRS mostraron que la StO2 aumentó tras cada aplicación de la matriz de WBC autóloga (Figura 5). Esto indicó mejoras en la perfusión tisular del área de las heridas, y fue el resultado de un incremento de oxígeno suministrado al área a través de la angiogénesis y/o una disminución en el uso de oxígeno.19 La medición de la StO2 es una combinación de las cantidades de oxígeno en capilares, vénulas y arteriolas.8 La StO2 del área de la herida depende de la relación entre el oxígeno suministrado al área y el oxígeno consumido por el tejido de la herida. La hipoxia es un factor inhibidor clave para la cicatrización de UPD, ya que los niveles bajos de oxígeno en el sitio de la herida pueden bloquear la proliferación de fibroblastos, producción de colágeno y angiogénesis capilar, y aumentar el riesgo de infección.10,20,19

Las mediciones cuantitativas tomadas con el NIRS reflejaron un aumento de StO2, HbO2 y tHb, y una disminución en Hb, lo que indicó un crecimiento de la angiogénesis en el tejido del área de la herida local (Cuadro 1, 2 y 3). Esta mejora se relaciona, también, con la reducción de la superficie de las heridas. El muestreo secuencial de las mediciones de pH confirmó que el procedimiento del tratamiento bajó el pH a niveles más favorables (el óptimo es entre 7,2 y 7,6), lo cual facilitó la migración de fibroblastos y queratinocitos, y el cierre acelerado de la herida.
Las heridas de difícil cicatrización, especialmente en pacientes con diabetes, representan desafíos clínicos. A menudo, se requieren productos avanzados para facilitar el cierre de las heridas, como las matrices dérmicas acelulares.21 Este estudio, si bien fue realizado con una muestra muy pequeña, despierta interés para estudios posteriores, con mayores muestras. La matriz de WBC autóloga fue eficaz en la curación de las tres UPD, y ayudó a mejorar la perfusión del tejido después de cada aplicación. El uso de NIRS y medidores de pH también fue útil para proporcionar al examinador evidencia objetiva de que el tratamiento con la matriz estaba siendo efectivo para avanzar en el cierre de las heridas después de la primera aplicación.
El mecanismo de acción de esta modalidad de tratamiento todavía no se comprende completamente. Se plantea la hipótesis de que el WBC puede estimular la curación y facilitar el movimiento de sustratos críticos, reducir la carga biológica, y fomentar la angiogénesis.17 Los datos NIRS y PAR obtenidos de los tres casos de estudio presentados apoyan esta hipótesis. Además, se plantea la hipótesis de que el WBC formado consiste en un tapón de plaquetas consolidado con una malla de fibrina, que sirve como andamio para la proliferación fibroblástica y la regeneración de tejidos.17 Se ha demostrado que los andamios biológicos que comprenden el MEC promueven la remodelación constructiva.22–24
Debido al alto riesgo de amputación, es fundamental que el profesional de la salud evalúe con cautela la eficacia de los protocolos de tratamiento al tratar pacientes con UPD. Cuatro semanas podrían ser una buena guía para determinar la eficacia de las estrategias de tratamiento empleadas. Al tratar UPD, un cambio porcentual en la superficie de la herida de 30% o más durante cuatro semanas es un buen indicador de la curación.25,26 Los medidores de pH y NIRS proporcionan mediciones adicionales para guiar al profesional de la salud en las decisiones del protocolo de tratamiento.
Limitaciones
Los dispositivos utilizados para medir la eficacia del tratamiento de forma objetiva (NIRS y medidor de pH) no están habitualmente disponibles en América latina. Es necesario un tamaño muestral mayor para obtener resultados más significativos, y un parámetro comparativo.
Conclusión
La matriz de WBC autóloga, creada con el sistema RD1, fue crucial para la cicatrización de las heridas estudiadas. En los tres casos, la superficie de la UPD se redujo después de cada aplicación, y se logró el cierre de las heridas.
Este estudio demostró, además, los beneficios para el profesional de la salud, capaz de observar factores tanto cualitativos como cuantitativos utilizando la tecnología NIRS y un medidor de pH dérmico, para obtener una curación en menos tiempo y con menores complicaciones. Se necesita un ensayo clínico más amplio para comprender mejor los beneficios y la progresión de la curación de la matriz de WBC autóloga para UPD de difícil cicatrización.
